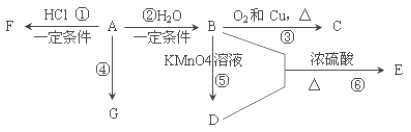
题目内容
【题目】a、b、c、d、e五种短周期元素的原子半径和最外层电子数之间的关系如图所示:下列说法正确的是
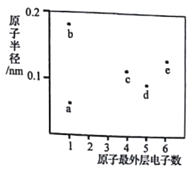
A. 离子半径:b>d
B. 沸点:a与d形成的化合物>a与c形成的化合物
C. a与b、c、d、e均可形成共价化合物
D. e的含氧酸可能既有氧化性又有还原性
【答案】D
【解析】试题分析:由图中信息可知,a、b两元素的原子最外层电子数都是1,a的半径最小,则a是H元素;e的最外层有6个电子,其半径仅比b小,则b、e分别为Na和S元素;c、d最外层分别有4和5个电子,则c、d分别为C和N元素。
A. 电子层结构相同的离子,核电荷数越大半径越小,故氮离子半径大于钠离子,A不正确; B. 沸点:H与N形成的化合物可能呈气态或液态,>H与C形成的化合物可能呈气态、液态或固态,所以无法比较两者的沸点,B不正确;C. H与C、N、S均可形成共价化合物,但是H与Na只能形成离子化合物,C不正确;D. S的含氧酸中有亚硫酸和硫酸等等,亚硫酸既有氧化性又有还原性,D正确。本题选D。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目