题目内容
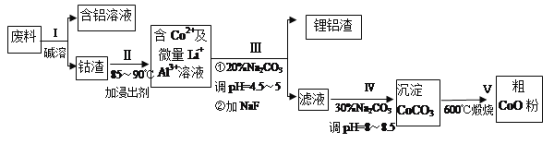
【题目】某研究小组用工业废料(主要含MgCO3、FeCO3和Al2O3等)回收镁的工艺流程如下:
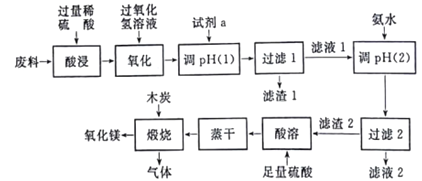
(1)酸浸过程中采用粉碎原料、加热、搅拌、适当增大硫酸的浓度等措施的目的是______;用过氧化氢溶液氧化时,发生的反应离子方程式为_________。
(2)为了不影响产品的纯度,试剂a应选择______(填编号)。
A.CuO B.Ca(OH)2 C.MgCO3 D.氨水
在用试剂a调节pH过程中,先生成的沉淀是______;当pH=5时,滤液1中Al3+和Fe3+的物质的量浓度之比为________(已知:298K时,Ksp[Al(OH)3]=3.0×10-34,Ksp[Fe(OH)3]=4.0×10-38)。
(3)写出生成滤渣2的离子方程式____________。
(4)煅烧过程存在以下反应:
2MgSO4+C=2MgO+2SO2↑+CO2↑ MgSO4+C=MgO+SO2↑+CO↑ MgSO4+3C=MgO+SO2↑+3CO↑
为测定煅烧后产生的气体中各组分含量,进行如下实验:将气体冷却至标准状况后取22.4mL气体,经Ba(OH)2溶液充分吸收,剩余7mL气体(标准状况);所得沉淀用足量硝酸溶解,再经过滤、洗涤、干燥、称量得沉淀0.1165g。则混合气体中SO2、CO2、CO体积比为_____(填最简整数比)。
【答案】 提高酸浸速率 H2O2+2Fe2++2H+=2Fe3++2H2O C D Fe(OH)3 7500或7500:1 2NH3·H2O+Mg2+=Mg(OH)2↓+2NH4+ 8:3:5
【解析】试题分析:由流程可知,废料经酸溶后,再加双氧水把亚铁离子氧化为铁离子,然后加入氧化镁或碳酸镁调节溶液的pH至铁离子和铝离子完全沉淀,接着向滤液中加入氨水把镁离子完全沉淀,过滤后得的氢氧化镁经酸溶、蒸干得到硫酸镁,最后煅烧硫酸镁得到氧化镁。
(1)酸浸过程中采用粉碎原料、加热、搅拌、适当增大硫酸的浓度等措施的目的是提高酸浸速率;用过氧化氢溶液氧化时,发生的反应离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O。
(2)为了不影响产品的纯度,试剂a应选择氨水或MgCO3,选C D。由于Ksp[Fe(OH)3]小于Ksp[Al(OH)3],所以,在用试剂a调节pH过程中,先生成的沉淀是Fe(OH)3;当pH=5时,c(OH-)=![]() mol/L,滤液1中Al3+和Fe3+的物质的量浓度之比为
mol/L,滤液1中Al3+和Fe3+的物质的量浓度之比为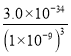 :
: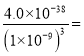 7500(或7500:1)。
7500(或7500:1)。
(3)生成滤渣2的离子方程式为2NH3·H2O+Mg2+=Mg(OH)2↓+2NH4+。
(4) 标准状况下22.4mL气体经Ba(OH)2溶液充分吸收后,剩余7mL气体(标准状况),剩余气体为CO;所得沉淀用足量硝酸溶解,再经过滤、洗涤、干燥、称量得硫酸钡沉淀0.1165g,则n(SO2)=n(BaSO4)= ![]() , SO2体积为11.2mL,CO2的体积为22.4mL-7mL-11.2mL=4.2mL,所以,混合气体中SO2、CO2、CO体积比为8:3:5。
, SO2体积为11.2mL,CO2的体积为22.4mL-7mL-11.2mL=4.2mL,所以,混合气体中SO2、CO2、CO体积比为8:3:5。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案