题目内容
【题目】已知: ①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
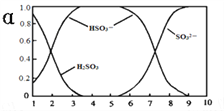
②25℃时,2×l0﹣3molL﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示:
请根据以下信息回答下列问题:
(1)25℃时,将20mL 0.10molL﹣1CH3COOH溶液和20mL 0.l molL﹣1 HSCN溶液分别 与20mL 0.10molL﹣1NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示: 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ .
(3)4×10﹣3molL﹣1HF溶液与4×10﹣4molL﹣1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
【答案】
(1)相同的起始条件,两种酸的电离程度不同导致溶液中起始反应时氢离子浓度不同引起反应速率不同;<
(2)4×10﹣4
(3)有沉淀产生.
【解析】解:(1)①反应速率与氢离子浓度成正比,硫氰酸的电离平衡常数大于醋酸,则硫氰酸的电离程度大于醋酸,等浓度的两种溶液中,硫氰酸中氢离子浓度大于醋酸,所以醋酸的反应速率小于硫氰酸;
酸的电离平衡常数越大,酸的电离程度越大则酸的酸性越强,其酸根水解能力越小,硫氰酸的电离平衡常数大于醋酸,所以醋酸根离子的水解能力大于硫氰酸根离子,则c(CH3COO﹣)<c(SCN﹣),
所以答案是:相同的起始条件,两种酸的电离程度不同导致溶液中起始反应时氢离子浓度不同引起反应速率不同;<;(2)根据图象知,当pH=4时,c(H+)=10﹣4 mol/L,c(F﹣)=1.6×10﹣3 mol/L,c(HF)=4×10﹣4 mol/L,电离平衡常数Ka= ![]() =
= ![]() =4×10﹣4,
=4×10﹣4,
所以答案是:4×10﹣4;(3)由图可知当pH=4.0时,溶液中的c(F﹣)=1.6×10﹣3molL﹣1,因等体积混合则溶液中c(Ca2+)=2.0×10﹣4molL﹣1,即c(Ca2+)×c2(F﹣)=5.1×10﹣10>Ksp(CaF2))=1.5×10﹣10,所以有沉淀产生,所以答案是:有沉淀产生.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案