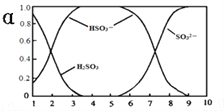
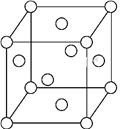
��Ŀ����
����Ŀ����������Ԫ�أ�����B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش�����
BԪ��ԭ�ӵĺ���p��������s��������1 |
Cԭ�ӵĵ�һ�����ĵ����ֱܷ��ǣ�I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
Dԭ�Ӻ�������p���ȫ������� |
EԪ�ص����������������������4 |
F ��ǰ������ԭ�ӵ����Ų�ͼ�е�����������Ԫ�� |
G�����ڱ��ĵ�ʮһ�� |
��1��B��̬ԭ�ӵĵ����Ų�ʽΪ��F��̬ԭ�ӵļ۵����Ų�ʽΪ��G��̬ԭ�ӵ����������Ų�ͼΪ ��
��2��C��������������Ԫ��ԭ�ӵĵ�һ�������ɴ�С��˳��������Ԫ�ط�����գ���
��3��B��D�ĵ縺����Դ�С��BD���á����ڡ�����С�ڡ����ڡ���գ���
��4����������Ԫ���У�λ��s�������֣�λ��p�������֣�
��5��DE3�ĵ���ʽΪ ��
���𰸡�
��1��1s22s22p3��3d54s1�� ![]()
��2��Mg��Al��Na
��3������
��4��1��4
��5��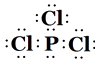
���������⣺��1��BΪNԪ�أ�ԭ�Ӻ�������Ų�Ϊ1s22s22p3��FΪCr����̬ԭ�ӵļ۵����Ų�ʽΪ3d54s1��GΪGa���������3�����ӣ���̬ԭ�ӵ����������Ų�ͼΪ ![]() �����Դ��ǣ�1s22s22p3��3d54s1��
�����Դ��ǣ�1s22s22p3��3d54s1�� ![]() ����2��CΪMgԪ�أ������Ϊȫ��������Ϊ�ȶ�����һ�����ܴ�С˳��ΪMg��Al��Na�����Դ��ǣ�Mg��Al��Na����3��ͬ����Ԫ�ش��ϵ��µ縺����С����N����P�����Դ��ǣ����ڣ���4����������Ԫ���У�Mgλ��s����N��P��Cl��Gaλ��p������4�֣����Դ��ǣ�1�� 4����5��PCl3Ϊ���ۻ��������ʽΪ
����2��CΪMgԪ�أ������Ϊȫ��������Ϊ�ȶ�����һ�����ܴ�С˳��ΪMg��Al��Na�����Դ��ǣ�Mg��Al��Na����3��ͬ����Ԫ�ش��ϵ��µ縺����С����N����P�����Դ��ǣ����ڣ���4����������Ԫ���У�Mgλ��s����N��P��Cl��Gaλ��p������4�֣����Դ��ǣ�1�� 4����5��PCl3Ϊ���ۻ��������ʽΪ 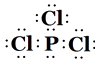 �����Դ��ǣ�
�����Դ��ǣ� 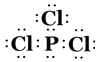 ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�