题目内容
【题目】在一定条件下,将N2、H2混合气体100 mL通入密闭容器内,达到平衡时,容器内的压强比反应前减小![]() ,测得此时混合气体的平均相对分子质量为9。试求:
,测得此时混合气体的平均相对分子质量为9。试求:
(1)原混合气中N2、H2各多少毫升______?
(2)H2的转化率是多少______?
【答案】20 mL、80 mL 37.5%
【解析】
(1)设出氢气、氮气的体积及转化的氮气体积,然后根据题中数据列式计算出a,然后根据容器内的压强比反应前减少1/5,利用化学平衡的三段式列式计算出原混合气体中N2和H2的体积;
(2)根据计算出转化的氮气计算出消耗的氢气体积,再计算出氢气的转化率。
(1)设原混合气体中N2的体积为x,H2的体积为y,反应中转化的N2的体积为a,则x+y=100mL ①

反应后气体的体积减小了2a,根据容器内的压强比反应前减少1/5,则达到平衡状态时气体的物质的量比反应前减少了![]() ,
,![]() =
=![]() ②,将①带人②解得,a=10mL,根据三段式:
②,将①带人②解得,a=10mL,根据三段式:
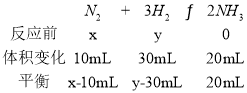
相同条件下,气体摩尔体积相同,设为Vm,根据质量守恒定律及反应后气体的体积可得,混合气体的平均分子量为: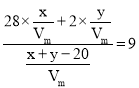 ③,由③化简有19x-7y+180=0 ④由①④联立,解得x=20mL,y=80mL;
③,由③化简有19x-7y+180=0 ④由①④联立,解得x=20mL,y=80mL;
(2)反应消耗10mL氮气,同时消耗了30mL氢气,所以氢气的转化率为:![]() ×100%=37.5%。
×100%=37.5%。

练习册系列答案
相关题目