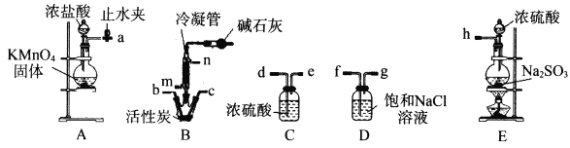
题目内容
【题目】已知可逆反应X(g)+2Y(g)Z(g)△H<0,一定温度下,在体积为2L的密闭容器中加入4mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列表述正确的是( )

A. 达到平衡时,X、Y、Z物质的量之比为1:2:1
B. a点正反应速率大于逆反应速率
C. 反应达平衡时,降低温度可以实现c到d的转化
D. 该条件下,反应达平衡时,X平衡转化率为25%
【答案】B
【解析】
A、分析图象和题给信息可知,起始加入X的物质的量为1mol/L×2L=2mol,起始加入2molX、4molY,达到平衡时X的浓度为0.25mol/L,物质的量为0.25mol/L×2L=0.5mol,消耗X物质的量2﹣0.5mol=1.5mol,结合化学方程式计算得到消耗Y物质的量为3mol,生成Z物质的量为1.5mol,则达到平衡时,X、Y、Z物质的量之比=0.5:(4mol﹣3mol):1.5mol=1:2:3,故A错误;
B、由图象可知,a点尚未达到平衡状态,此时正反应速率大于逆反应速率,故B正确;
C、该反应的△H<0,为放热反应,降低温度,平衡正向移动,X的浓度减小,不能实现c到d的转化,故C错误;
D、利用三段式计算:X(g)+2Y(g)Z(g)
起始浓度(mol/L) 1 2 0
转化浓度(mol/L) 0.75 1.5 0.75
平衡浓度(mol/L) 0.25 0.5 0.75
X平衡转化率为75%,故D错误。

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目