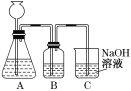
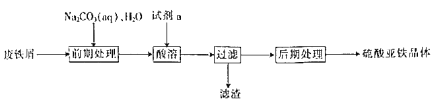
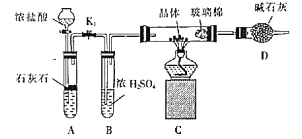
题目内容
【题目】甲、乙、丙三种物质之间有如下转化关系:
甲![]() 乙
乙![]() 丙
丙![]() 甲
甲
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是_________(写化学式,下同)。写出“乙![]() 丙”转化的离子方程式:______________________。
丙”转化的离子方程式:______________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________。写出“甲![]() 乙”转化的离子方程式:_________________。
乙”转化的离子方程式:_________________。
【答案】Al2O3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Fe2O3 Fe2O3+6H+=2Fe3++3H2O
【解析】
(1)甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则其为铝的化合物,与硫酸反应生成硫酸铝,与氨水反应生成的丙为Al(OH)3和硫酸铵,分解生成的甲为Al2O3。
(2)乙溶液中加入KSCN溶液,有红色出现,则乙为Fe2(SO4)3,与氨水反应生成的丙为Fe(OH)3和硫酸铵,分解产物甲为Fe2O3。
(1)据甲的性质及相关转化可知,甲为Al2O3,乙为Al2(SO4)3,丙为Al(OH)3。
则甲是Al2O3。“乙![]() 丙”转化的离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。答案为:Al2O3;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
丙”转化的离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。答案为:Al2O3;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(2)据乙溶液的性质及相关转化可知,甲为Fe2O3,乙为Fe2(SO4)3,丙为Fe(OH)3。
则甲物质是Fe2O3。写出“甲![]() 乙”转化的离子方程式:Fe2O3+6H+=2Fe3++3H2O。答案为:Fe2O3;Fe2O3+6H+=2Fe3++3H2O。
乙”转化的离子方程式:Fe2O3+6H+=2Fe3++3H2O。答案为:Fe2O3;Fe2O3+6H+=2Fe3++3H2O。

【题目】合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)在150℃时2L的密闭容器中,将2molCH4和2molH2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=__。
②在该温度下,计算该反应的平衡常数K=__。
③下列选项中能表示该反应已达到平衡状态的是__。
A.v(H2)逆=3v(CO)正
B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变
D.C(CH4)=C(CO)
(2)合成气制甲醚的反应方程式为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H=bkJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如图所示。
CH3OCH3(g)+H2O(g) △H=bkJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如图所示。
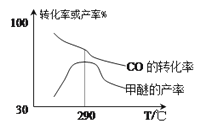
①290℃前,CO转化率和甲醚产率的变化趋势不一致的原因是__;
②b__0,(填“>”或“<”或“=”)理由是__。
(3)合成气中的氢气也用于合成氨气:N2+3H2![]() 2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是__;
2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是__;
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
容器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2mol | φ丙 | ν丙 | P丙 |