题目内容
【题目】硫酸亚铁晶体(FeSO4nH2O)是一种重要的食品和饲料添加剂。在实验室里可以通过下列流程用废铁屑制备。
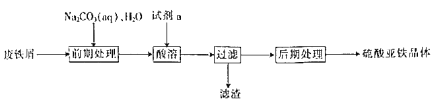
(1)试剂a是___(填写名称),上述流程中涉及的物质主要有①Na2CO3(aq)、②H2O、③试剂a、④废铁屑、⑤FeSO4nH2O,其中属于电解质的是___(填化学式),酸溶时发生的主要反应的化学方程式为___。
(2)上述流程中过滤操作所用的玻璃仪器有玻璃棒__、烧杯。
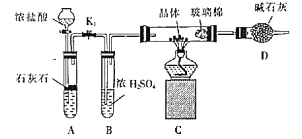
(3)利用如图装置对所得产品(FeSO4nH2O)结晶水的含量进行测定。反应前称量C中的硬质玻璃管(80g)、装入晶体后的硬质玻璃管(93g)。反应后称得C中硬质玻璃管的质量为87.6g。则产品硫酸亚铁晶体(FeSO4nH2O)中n=__。
【答案】稀硫酸 H2O、FeSO4nH2O Fe+H2SO4=FeSO4+H2↑ 漏斗 6
【解析】
(1)除去杂质时不能引入新的杂质;水溶液或熔融状态下能导电的化合物为电解质;
(2)过滤操作时需要玻璃棒、烧杯和漏斗;
(3)晶体的质量为93-80=13g,加热完全分解后剩余固体的质量为87.6-80=7.6g,根据二者的质量之比的关系可计算n的值。
(1)制备硫酸亚铁晶体,为不引入杂质,选择稀硫酸溶解;
①Na2CO3(aq)为混合物,不是电解质也不是非电解质;
②H2O可以导电,为电解质;
③试剂a为稀硫酸,混合物,不是电解质,也不是非电解质;
④废铁屑为单质,不是电解质也不是非电解质;
⑤FeSO4nH2O溶解后可导电,为电解质;
因此电解质为:H2O和FeSO4nH2O
酸溶时发生的主要反应的化学方程式为Fe+H2SO4=FeSO4+H2↑;
(2)过滤需要玻璃棒、烧杯、漏斗;
(3)晶体的质量为93g-80g=13g,加热完全分解后剩余固体的质量为87.6g-80g=7.6g,则有![]() =
=![]() ,解得n=6。
,解得n=6。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】Ⅰ.甲醇是重要的化学工业基础原料和清洁液体燃料,工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)
(2)反应③的ΔS__________0(填“>”、“<”);反应③的ΔH__________0(填“>”、“<”)
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正__________V逆(填“>”、“=”或“<”)
Ⅱ.一定条件下,在容积为2L的密闭容器中充入lmolCO与2molH2合成甲醇,平衡转化率与温度、压强的关系如图所示:
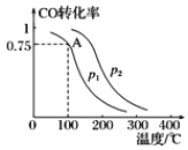
(1)p1__________p2(填“>”、“=”或“<”)。
(2)该反应达到平衡时,反应物转化率的关系是CO____________H2(填“>”、“=”或“<”)。
(3)若100℃P1时达平衡所用的时间为5min,则从开始到平衡这段时间用H2表示的速率为_______________________。
(4)该甲醇合成反应在A点的平衡常数K=___________。