题目内容
【题目】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全充满或半充满。
(1)写出四种元素的元素符号:
A________,B________,C________,D________。
(2)写出C、D两种元素基态原子核外电子轨道表示式。
C_______________________________________________________________,
D_______________________________________________________________。
(3)写出B、C两种元素单质在一定条件下反应的化学方程式____________________________________________。
(4)写出B元素单质和氢化物的电子式:单质________,氢化物__________。
【答案】H N Mg P ![]()
![]() N2+3Mg=Mg3N2
N2+3Mg=Mg3N2 ![]()
![]()
【解析】
有A、B、C、D四种短周期的主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,则A为氢元素;B元素原子的核外p轨道电子数比s轨道电子数少1,B原子核外电子排布为1s22s22p3,为N元素;C为金属元素且原子核外p轨道电子数和s轨道电子数相等,原子序数大于氮元素,处于第三周期,核外电子排布为1s22s22p63s2,则C为Mg元素,D元素的原子核外所有p轨道全满或半满,原子序数大于Mg,则核外电子排布为1s22s22p63s23p3,则D为P元素,据此解答。
(1)由上述分析可知,A为H、B为N、C为Mg、D为P;
故答案为:H;N;Mg;P;
(2)C为Mg元素,基态原子的电子排布图为:![]() ,
,
D为P元素,基态原子的电子排布图为:![]() ;
;
故答案为:![]() ;
;![]() ;
;
(3)镁在氮气中燃烧生成氮化镁,方程式为:N2+3Mg=Mg3N2;
故答案是:N2+3Mg=Mg3N2;
(4)B元素单质为N2、氢化物为NH3,氮气电子式为:![]() ,NH3的电子式为:
,NH3的电子式为:![]() ;故答案为:
;故答案为:![]() 、
、![]() 。
。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
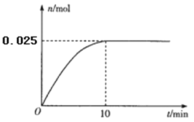
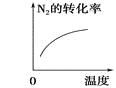
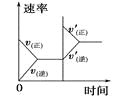
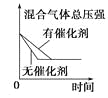
启东小题作业本系列答案【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D