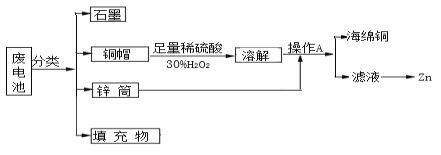
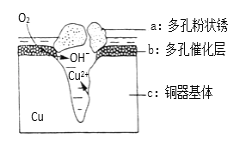
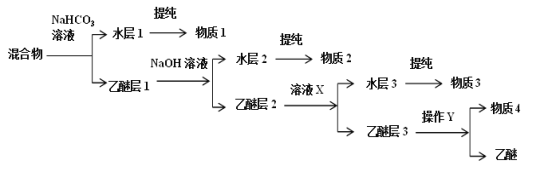
题目内容
【题目】通过下列实验现象的分析,对实验事实的解释正确的是( )
A.向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性
B.H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强
C.用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,说明浓氨水呈碱性
D.常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸发应
【答案】C
【解析】
A.溶液中的CO32-发生水解,CO32-+H2O![]() HCO3-+OH-,加入BaCl2溶液发生反应,Na2CO3+BaCl2=BaCO3↓+2NaCl,CO32-浓度减小,水解平衡逆向移动,溶液的碱性减弱,溶液褪色,并不是BaCl2有酸性,A错误;
HCO3-+OH-,加入BaCl2溶液发生反应,Na2CO3+BaCl2=BaCO3↓+2NaCl,CO32-浓度减小,水解平衡逆向移动,溶液的碱性减弱,溶液褪色,并不是BaCl2有酸性,A错误;
B.H2S通入CuSO4溶液中发生反应H2S+CuSO4=CuS↓+H2SO4,生成黑色沉淀为CuS和H2SO4;由化学平衡移动可知,CuS沉淀的生成使得反应得以发生,不是体现了弱酸制备强酸的规律,硫酸的酸性大于硫化氢,B错误;
C.试纸变蓝色,说明浓氨水呈碱性,C正确;
D.铝与冷的浓硫酸发生钝化,而不是不反应,D错误;
答案选C。

【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 向0.1mol/L碳酸钠溶液中滴入酚酞,溶液变红,加热,红色加深。 | 碳酸钠属于弱碱 |
B | 测定醋酸溶液pH,用玻璃棒蘸取溶液,点在pH试纸上,试纸显红色。 | 醋酸溶液显酸性 |
C | 将铜片和锌片用导线相连,插入CuSO4溶液中,锌片质量减小,铜片质量增加。 | 锌被还原 |
D | 向氯化银的浊液中滴入KI溶液,浊液中的固体由白色变为黄色。 | Ksp(AgCl)<Ksp(AgI) |
A.AB.BC.CD.D
【题目】今有室温下四种溶液,下列有关叙述不正确的是( )
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2