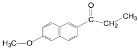
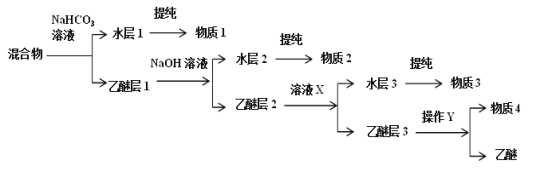
题目内容
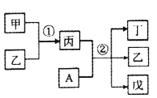
【题目】短周期元素a、b、c、d的原子序数依次增大。其中A为d元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物,常温下乙为液体。下列说法正确的是
A.简单离子半径:c >b
B.反应①为吸热反应
C.②在常温下反应时,氧化剂与还原剂物质的量之比为1:1
D.b、d分别与a形成的化合物中,化学键类型一定完全相同
【答案】C
【解析】
短周期元素a、b、c、d的原子序数依次增大,常温下乙为液体,乙应该为H2O;甲+乙→丙,丙+A→丁+乙(H2O)+戊,A为d元素组成的单质,甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物,则a为H、b为O、c为Na、d为Cl,甲为Na2O、丙为NaOH、A为Cl2,据此进行解答。
根据分析可知a、b、c、d分别为H、O、Na、Cl;A为Cl2,甲为Na2O、丙为NaOH;
A. c、b的简单离子为Na+、O2-,两者具有相同的电子层结构,核电荷数越大离子半径越小,故简单离子半径:c <b,故A错误;
B. 反应①为Na2O与水的化合反应,为放热反应,故B错误;
C. 常温下②的反应为Cl2+2NaOH=NaCl+NaClO+H2O,氧化剂和还原剂都是氯气,物质的量之比为1:1,故C正确;
D. b、d分别与a形成的化合物为H2O、H2O2、HCl,H2O、HCl中只有极性键,H2O2中既有极性键又有非极性键,化学键类型不一定完全相同,故D错误;
答案选C。

练习册系列答案
 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目