题目内容
20.500mL0.5mol/LH2SO4溶液,其中含H+为0.5mol,配制该溶液,需10mol/LH2SO4溶液的体积为25mL.分析 n(H2SO4)=0.5mol/L×0.5L=0.25mol,每个硫酸分子能电离出2个氢离子,则n(H+)=2n(H2SO4);
溶液稀释前后溶质的物质的量不变,据此计算浓硫酸体积.
解答 解:n(H2SO4)=0.5mol/L×0.5L=0.25mol,每个硫酸分子能电离出2个氢离子,则n(H+)=2n(H2SO4)=2×0.25mol=0.5mol;
溶液稀释前后溶质的物质的量不变,则浓硫酸体积=$\frac{0.25mol}{10mol/L}$=25mL,
故答案为:0.5;25.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,明确分子构成是解本题关键,熟练掌握物质的量有关公式,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
10.能源问题是当今世界持续关注的问题,在2012年初的世界未来能源峰会上,联合国秘书长潘基文宣布2012年为“人人享有可持续能源国际年”.下列关于反应热的说法正确的是( )
| A. | 当△H为负值时,表示该反应为吸热反应 | |
| B. | 反应热的大小与反应物所具有的能量和生成物具有的能量无关 | |
| C. | 反应热的大小只与反应体系的始态和终态有关 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
8.下列离子方程式中错误的是( )
| A. | 碳酸镁与H2SO4反应 MgCO3+2H+=Mg2++H2O+CO2↑ | |
| B. | 向硝酸银溶液中加盐酸:Ag++Cl-=AgCl↓ | |
| C. | 铁与稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| D. | 澄清石灰水与盐酸的反应 H++OH-=H2O |
5.某有机化合物的结构简式如图,有关该化合物的叙述不正确的是( )
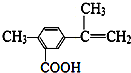

| A. | 该有机物的分子式为C11H12O2 | |
| B. | 1mol该物质最多能与4molH2发生加成反应 | |
| C. | 该有机物一定条件下,可以发生取代、氧化、酯化反应 | |
| D. | 该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 |
9.下列有关元素周期律的叙述中正确的是( )
| A. | 氧化性:F2<Cl2 | B. | 气态氢化物的稳定性:H2O<H2S | ||
| C. | 酸性:H3PO4<H2SO4 | D. | 粒子半径:Na+>Na |
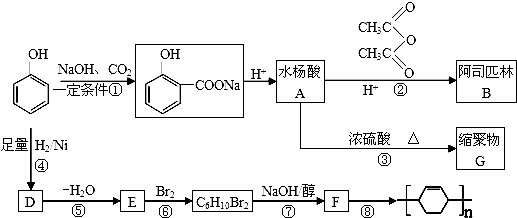
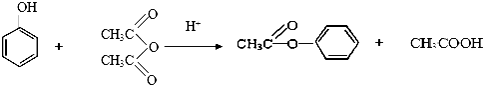
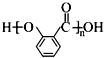 ;⑤的反应条件是NaOH的醇溶液、加热;⑧的反应类型是加聚反应.
;⑤的反应条件是NaOH的醇溶液、加热;⑧的反应类型是加聚反应.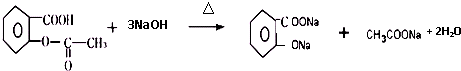 .
.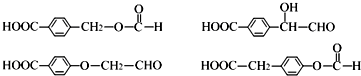 .
.