题目内容
11.用含碳酸钙40%的大理石100g与过量的4mol/L的盐酸溶液反应,求:(1)碳酸钙的物质的量
(2)消耗盐酸溶液的体积
(3)产生CO2在标况下的体积.
分析 (1)根据质量分数计算碳酸钙质量,再根据n=$\frac{m}{M}$计算碳酸钙物质的量;
(2)发生反应:CaCO3+2HCl=CaCl2+H2O+CO2↑,根据方程式计算消耗HCl物质的量,再根据V=$\frac{n}{c}$计算消耗盐酸的体积;
(3)根据方程式计算生成二氧化碳的物质的量,根据V=nVm计算二氧化碳体积.
解答 解:(1)碳酸钙质量为100g×40%=40g,碳酸钙物质的量为$\frac{40g}{100g/mol}$=0.4mol,
答:碳酸钙的物质的量为0.4mol;
(2)由CaCO3+2HCl=CaCl2+H2O+CO2↑,可知消耗HCl物质的量为0.4mol×2=0.8mol,则消耗盐酸的体积为$\frac{0.8mol}{4mol/L}$=0.2L,
答:消耗盐酸的体积为0.2L;
(3)由CaCO3+2HCl=CaCl2+H2O+CO2↑,可知n(CO2)=n(CaCO3)=0.4mol,故标况下生成二氧化碳体积为0.4mol×22.4L/mol=8.96L,
答:标况下生成二氧化碳体积为8.96L.
点评 本题考查化学方程式计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
2.某有机物的结构如图所示,下列说法正确的是( )
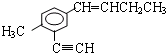

| A. | 与乙苯互为同系物 | |
| B. | 分子中共直线的原子最多有4个 | |
| C. | 分子中共平面的碳原子最多有12个 | |
| D. | 与其互为同分异构体且萘环上只有一个侧链的共有4种 |
19.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个 | |
| B. | 11.2 L NH3中所含的原子数为2NA | |
| C. | 2.4g金属镁变为Mg2+时失去的电子数为0.1 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA个 |
6.某气态烃1mol跟2mol氯化氢加成,其加成产物又可被8mol氯气完全取代,该烃可能是( )
| A. | 丙烯 | B. | 乙烯 | C. | 2-丁炔 | D. | 丙炔 |
1.下列离子能大量共存的是( )
| A. | 使酚酞试液变红的溶液:Na+,K+,SO${\;}_{4}^{2-}$,HCO${\;}_{3}^{-}$ | |
| B. | 无色透明的溶液中:MnO${\;}_{4}^{-}$,K+,SO${\;}_{4}^{2-}$,Na+ | |
| C. | 含有大量Mg2+的溶液中:Fe2+,SO${\;}_{4}^{2-}$,NO${\;}_{3}^{-}$,Cl- | |
| D. | 使紫色石蕊试液变红的溶液:NH${\;}_{4}^{+}$,NO${\;}_{3}^{-}$,Al3+,CH3COO- |