题目内容
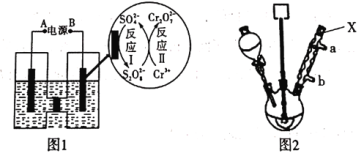
【题目】无水三氯化铁呈棕红色,易潮解,100℃左右时升华,冷却后易凝华。下图是两名学生设计的用氯气与铁反应制备无水三氯化铁的实验装置。左边的反应装置相同,而右边的产品收集装置则不同,分别如(I)和(II)所示。试回答:

(1)A仪器的名称是_____________________;
(2)B中反应![]() 离子方程式为______________________;其中浓盐酸表现出的性质为________;若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12 L(标准状况)的原因是______________;
离子方程式为______________________;其中浓盐酸表现出的性质为________;若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12 L(标准状况)的原因是______________;
(3)气体通过装置C![]() 目的是________________;
目的是________________;
(4)D中的反应开始前,需进行的操作是___________,应采取的方法是__________________;
(5)写出最佳方法鉴别D中产物的离子方程式:__________________________________________;
(6)装置(I)的主要缺点是_______________________________________________;
(7)如果选用(II)装置来完成实验,则必须采取的改进措施是__________________________。
【答案】(球形)分液漏斗 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 酸性和还原性 随着反应的进行,浓盐酸的浓度逐渐减小变为稀盐酸,反应停止 吸收水蒸气,干燥氯气 排除装置中的空气 B中的反应进行一段时间后,看到黄绿色气体充满整个装置,再开始加热D Fe3++3SCN- =Fe(SCN)3 氯化铁升华后遇冷凝华,导管易被堵塞,尾气排入空气,会造成环境污染 在瓶E和F之间连接装有干燥剂的装置
Mn2++Cl2↑+2H2O 酸性和还原性 随着反应的进行,浓盐酸的浓度逐渐减小变为稀盐酸,反应停止 吸收水蒸气,干燥氯气 排除装置中的空气 B中的反应进行一段时间后,看到黄绿色气体充满整个装置,再开始加热D Fe3++3SCN- =Fe(SCN)3 氯化铁升华后遇冷凝华,导管易被堵塞,尾气排入空气,会造成环境污染 在瓶E和F之间连接装有干燥剂的装置
【解析】
A和B即实验室制氯气的装置,C中浓硫酸起到干燥作用,D中即装有铁粉,和氯气反应得到三氯化铁,再来看右边的装置I和装置II,两者都是为了收集凝华下来的氯化铁,装置I比较容易造成导管堵塞,因此不是最理想的,装置II的E、F之间缺少一个干燥剂装置,烧碱溶液中的水蒸气会进入E装置,导致氯化铁水解,据此来分析即可。
(1)A的名称是分液漏斗;
(2)B中即制取氯气的反应:![]() ,浓盐酸表现出了酸性(形成了盐)和还原性(被氧化为氯气);反应中浓盐酸会挥发,且只有浓盐酸会发生反应,反应一段时间后盐酸浓度下降,反应就停止了,因此得到的氯气总是会小于理论值;
,浓盐酸表现出了酸性(形成了盐)和还原性(被氧化为氯气);反应中浓盐酸会挥发,且只有浓盐酸会发生反应,反应一段时间后盐酸浓度下降,反应就停止了,因此得到的氯气总是会小于理论值;
(3)产生的氯气中会有少量水蒸气,因此装置C的作用是干燥氯气;
(4)因为铁受热后极易被氧气氧化,因此反应开始前应排去装置内的空气,可以先制氯气,让氯气将装置内的空气“赶”走后,再点燃D中的酒精灯,开始反应;
(5)检验![]() 的最好的办法就是用
的最好的办法就是用![]() 溶液:
溶液:![]() ;
;
(6)装置I中氯化铁升华后遇冷凝华,导管易被堵塞,尾气排入空气,会造成环境污染;
(7)装置II的E、F之间缺少一个干燥剂装置,烧碱溶液中的水蒸气会进入E装置,导致氯化铁水解,因此在E、F之间加一个装有干燥剂的装置即可。

【题目】纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是( )
A | B | C | D |
|
|
|
|
银器用除锈剂除锈 | 变形的金属香炉复原 | 古画水洗除尘 | 木器表面擦拭烫蜡 |
A.AB.BC.CD.D