题目内容
【题目】碱式次氯酸镁[Mg2ClO(OH)3H2O]微溶于水,不潮解,相对稳定,是一种有开发价值的无机抗菌剂,以菱镁矿(MgCO3,含少量FeCO3)为主要原料制备碱式次氯酸镁的工业流程如下:
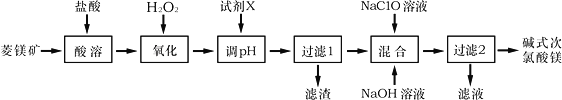
回答下列问题:
(1)菱镁矿“酸溶”时,为了提高溶出率,可采取的措施有________________(写一条)。
(2)H2O2的电子式为___________,它的作用是___________________________________。
(3)“调pH”时加入的试剂X为______________(填化学式)。
(4)“混合”时发生反应的化学方程式为__________________________________________。
“混合”时NaOH溶液需最后加入且不能过量,其原因是__________________________。
(5)在酸性溶液中碱式次氯酸镁具有杀菌、漂白作用的原因是_____________(用离子方程式表示)。
(6)如果以单位质量的消毒剂所得到的电子数来表示消毒效率,碱式次氯酸镁的消毒效率是Cl2的消毒效率的_______倍(计算结果保留两位小数)。
【答案】 粉碎菱镁矿或增大盐酸浓度等 ![]() 将Fe2+氧化为Fe3+ MgO [Mg(OH)2 、MgCO3或Mg(OH)2CO3] NaClO+2MgCl2+3NaOH+H2O=Mg2ClO(OH)3H2O↓+4NaCl 防止生成Mg(OH)2沉淀 Mg2ClO(OH)3H2O+4H+ =2Mg2++HClO+4H2O (或Mg2ClO(OH)3+4H+ =2Mg2++HClO+3H2O) (2分) 0.42
将Fe2+氧化为Fe3+ MgO [Mg(OH)2 、MgCO3或Mg(OH)2CO3] NaClO+2MgCl2+3NaOH+H2O=Mg2ClO(OH)3H2O↓+4NaCl 防止生成Mg(OH)2沉淀 Mg2ClO(OH)3H2O+4H+ =2Mg2++HClO+4H2O (或Mg2ClO(OH)3+4H+ =2Mg2++HClO+3H2O) (2分) 0.42
【解析】(1)菱镁矿“酸溶”时,可通过粉碎菱镁矿、增大盐酸浓度或加热、搅拌等措施溶出率;
(2)H2O2是共价化合物,其电子式为![]() ,滴中过氧化氢的目的是为了将Fe2+氧化为Fe3+;
,滴中过氧化氢的目的是为了将Fe2+氧化为Fe3+;
(3)添加试剂X既能与H+反应,同时不引入杂质,则可选用MgO [Mg(OH)2 、MgCO3或Mg(OH)2CO3];
(4)向MgCl2溶液中滴加NaOH、NaClO的混合溶液,生成Mg2ClO(OH)3H2O,发生反应的化学方程式为NaClO+2MgCl2+3NaOH+H2O=Mg2ClO(OH)3H2O↓+4NaCl;开始加入氢氧化钠或氢氧化钠过量,会生成Mg(OH)2沉淀,故混合时NaOH溶液需最后加入且不能过量;
(5)碱式次氯酸镁在酸性溶液中会生成HClO,能杀菌、漂白作用,发生反应的离子方程式为Mg2ClO(OH)3H2O+4H+ =2Mg2++HClO+4H2O;
(6)假设质量都是mg,Mg2ClO(OH)3H2O→Cl-得2个电子,Cl2→2Cl-得2个电子,所以Mg2ClO(OH)3H2O得到的电子的物质的量为![]() ×2=
×2=![]() mol,Cl2得到的电子的物质的量为
mol,Cl2得到的电子的物质的量为![]() ×2=
×2=![]() mol,所以
mol,所以![]() mol∶
mol∶![]() mol=0.42。
mol=0.42。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案


