题目内容
【题目】已知含铜离子的颜色主要有Cu(H2O)42+(蓝色)、CuCl42(黄色)、Cu(NH3)42+(深蓝色)等。
(1)16g铜在足量的氯气中燃烧生成固体产物放出的热量为56.8kJ。写出铜在氯气中燃烧的热化学方程式为______________________________________。
(2)向氯化铜溶液中滴加氨水至过量,最终生成Cu(NH3)42+,观察到的现象是________。
(3)CuCl2溶液中的铜主要以Cu(H2O)42+、CuCl42形式存在,将CuCl2溶于浓盐酸中,存在下列平衡:Cu(H2O)42+ (aq)+4Cl (aq)![]() CuCl42 (aq)+4H2O(l) △H<0
CuCl42 (aq)+4H2O(l) △H<0
①该反应的平衡常数表达式为____________。
②常温下,测定平衡体系中:Cu(H2O)42+浓度为a mol·L1、Cl浓度为b mol·L1、CuCl42浓度为c mol·L1,Cl的转化率为____________(用含a、b、c的字母表示)。
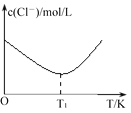
③将c1 mol·L1CuCl2溶液和c2 mol·L1 HCl溶液等体积混合,测得混合溶液中c(Cl)与温度T的关系如右图所示。简述温度高于T1 K时,随着温度升高,c(Cl)增大的原因___________。
④用惰性电极电解浓度较大CuCl2溶液,阳极的电极反应式为_________________,当电解到一定程度,阴极附近出现蓝色Cu(OH)2絮状物。常温下,经测定阴极附近溶液的pH=m,
此时阴极附近c(Cu2+)=___________ mol·L1 (已知:Cu(OH)2的Ksp=2.2×1020)。
【答案】 Cu(s)+Cl2(g)=CuCl2(s) △H=-227.2kJ/mol 蓝色溶液中逐渐产生蓝色沉淀,随后沉淀逐渐溶解,最终变成深蓝色溶液。 c(CuCl42)/c(Cl)4c[Cu(H2O)42+] 4c/(b+4c) 该反应的正反应是放热反应,T1 K时达到平衡,升高温度,平衡逆向移动 2Cl—2e=Cl2↑ 2.2×10(8—2m)
【解析】(1)16g铜的物质的量为![]() =0.25mol,则1molCu在氯气中完全燃烧放出的热量为56.8kJ×
=0.25mol,则1molCu在氯气中完全燃烧放出的热量为56.8kJ×![]() =227.2kJ;铜在氯气中燃烧的热化学方程式为Cu(s)+Cl2(g)=CuCl2(s) △H=-227.2kJ/mol;
=227.2kJ;铜在氯气中燃烧的热化学方程式为Cu(s)+Cl2(g)=CuCl2(s) △H=-227.2kJ/mol;
(2)向氯化铜溶液中滴加氨水至过量, 可看到蓝色溶液中逐渐产生蓝色沉淀,随后沉淀逐渐溶解,最终变成深蓝色Cu(NH3)42+溶液;
(3)①反应Cu(H2O)42+ (aq)+4Cl (aq)![]() CuCl42 (aq)+4H2O(l) 的平衡常数表达式为K=c(CuCl42)/c(Cl)4c[Cu(H2O)42+];
CuCl42 (aq)+4H2O(l) 的平衡常数表达式为K=c(CuCl42)/c(Cl)4c[Cu(H2O)42+];
②已知Cu(H2O)42+ (aq)+4Cl (aq)![]() CuCl42 (aq)+4H2O(l) 平衡体系中:Cu(H2O)42+浓度为amol·L1、Cl浓度为b mol·L1、CuCl42浓度为c mol·L1,则变化Cl的浓度为4c mol·L1,起始Cl的浓度为(b+4c)mol·L1,Cl的转化率为
CuCl42 (aq)+4H2O(l) 平衡体系中:Cu(H2O)42+浓度为amol·L1、Cl浓度为b mol·L1、CuCl42浓度为c mol·L1,则变化Cl的浓度为4c mol·L1,起始Cl的浓度为(b+4c)mol·L1,Cl的转化率为![]() ;
;
③由图示可知该反应的正反应是放热反应,T1 K时达到平衡,升高温度,平衡逆向移动,故随着温度升高,c(Cl)增大;
④用惰性电极电解浓度较大CuCl2溶液,阳极发生氧化反应,其电极反应式为2Cl—2e=Cl2↑;Ksp=c2(OH-)×c(Cu2+),c(Cu2+)=![]() =2.2×10(8—2m)mol·L1 。
=2.2×10(8—2m)mol·L1 。