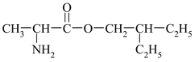题目内容
【题目】斑蝥素具有良好的抗肿瘤活性。下列是斑蝥素的一种合成路线:
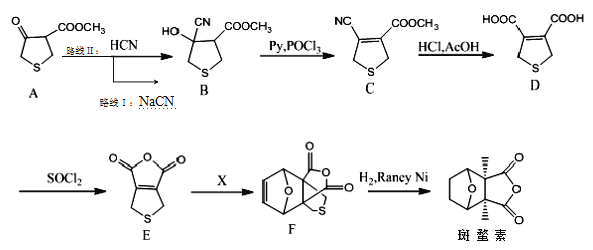
已知:ⅰ.其它条件不变,通常反应物浓度越大速率越快,多步反应时速率由最慢反应决定;
ⅱ.狄尔斯阿尔德反应:![]()
(1)有机化合物A的分子式为__。
(2)A转化为B时,路线Ⅰ和路线Ⅱ均在水溶液中进行。实验发现:路线Ⅰ比路线Ⅱ所需时间短,试解释原因__。
(3)写出B→C的化学方程式__。
(4)D与乙二醇发生缩聚反应的化学方程式为__。
(5)①X的结构简式是__。
②下表研究了__对合成F的影响,合成F的较优条件为__(填编号)。
编号 | 离子液体X | 反应温度/℃ | 反应时间/h | E含量/% | F含量/% | |
1 | [BPy]BF4 | 45 | 20 | 90 | 9 | |
2 | [HMIM]PF6 | 35 | 20 | 5 | 93 | |
3 | [BMIM]BF4 | 25 | 30 | 0 | 90 | |
4 | [HMIM]BF4 | 35 | 20 | 38 | 57 | |
5 | [BMIM]BF4 | 25 | 20 | 0 | 86 |
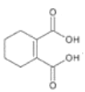
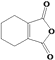
(6)请写出以![]() 为原料制备
为原料制备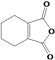 的合成路线流程图__(无机试剂任选,合成路线流程图示见本题题干)。
的合成路线流程图__(无机试剂任选,合成路线流程图示见本题题干)。
【答案】C6H8O3S HCN为弱酸,其水溶液中CN-浓度远小于NaCN里的,因此路线I反应快,所需时间短 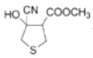
![]()
 +H2O n
+H2O n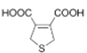 +nHOCH2CH2OH→
+nHOCH2CH2OH→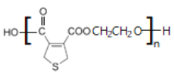 +(2n-1)H2O
+(2n-1)H2O ![]() 离子液体和反应温度 5
离子液体和反应温度 5 ![]()
![]()

![]()
![]()
![]()
![]()
【解析】
(1)由A的结构简式可知,A分子中含有6个C原子、8个H原子、3个O原子、1个S原子;
(2)第一步为慢反应,溶液CN浓度越小反应速率越慢,HCN属于弱酸,其水溶液中CN浓度远小于NaCN;
(3)B→C转化是B分子内脱去1分子水形成碳碳双键生成C;
(4) 与HOCH2CH2OH发生缩聚反应生成
与HOCH2CH2OH发生缩聚反应生成 ;
;
(5)①由原子守恒可知,E→F的反应类型为加成反应,进而推断X的结构简式;
②由表中数据可知,研究了离子液体、反应温度对合成F的影响;在常温下反应,F的含量越高、E的含量越低越好;
(6)![]() 发生催化氧化生成
发生催化氧化生成 ,再与NaCN反应生成
,再与NaCN反应生成 ,然后与Py、POCl3反应生成
,然后与Py、POCl3反应生成 ,再与HCl/乙酸反应生成
,再与HCl/乙酸反应生成 ,最后在SOCl2作用下生成
,最后在SOCl2作用下生成 。
。
(1)由A的结构简式可知,A分子中含有6个C原子、8个H原子、3个O原子、1个S原子,故A的分子式为:C6H8O3S;
(2)酮与HCN或NaCN加成历程中第一步为慢反应,决定反应速率,HCN属于弱酸,其水溶液中CN浓度远小于NaCN,路线I的反应速率快,所需时间短;
(3)B→C转化是B分子内脱去1分子水形成碳碳双键生成C,反应方程式为:
![]()
 +H2O;
+H2O;
(4) 与HOCH2CH2OH发生缩聚反应生成
与HOCH2CH2OH发生缩聚反应生成 ,反应方程式为:n
,反应方程式为:n +nHOCH2CH2OH→
+nHOCH2CH2OH→ +(2n-1)H2O;
+(2n-1)H2O;
(5)①由原子守恒可知,E与X发生加成反应生成F,则X的结构简式为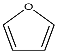 ;
;
②由表中数据可知,研究了离子液体、反应温度对合成F的影响;合成F的较优条件为5,因为在[BMIM]BF4离子液体中,反应在常温条件下进行,得到F的含量高,而不含E;
(6) ![]() 发生催化氧化生成
发生催化氧化生成 ,再与NaCN反应生成
,再与NaCN反应生成 ,然后与Py、POCl3反应生成
,然后与Py、POCl3反应生成 ,再与HCl/乙酸反应生成
,再与HCl/乙酸反应生成 ,最后在SOCl2作用下生成
,最后在SOCl2作用下生成 ,合成路线流程图为:
,合成路线流程图为:![]()
![]()

![]()

![]()

![]()

![]()
 .
.

【题目】常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | c(HA)/mol·L-1 | c(NaOH)/ mol·L-1 | 混合溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.2 | 0.2 | pH=9 |
丙 | c1 | 0.2 | pH=7 |
丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是
A. a>9B. 在乙组混合液中由水电离出的c(OH-)=10-5 mol·L-1
C. c1=0.2D. 丁组混合液中:c(Na+)>c(A-)>c(H+)>c(OH-)