题目内容
4.图中的A、B、C、D、E、F、G均为有机物(有些物质未写出),据图回答问题:(1)A的结构简式
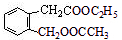 ,D的名称是乙醇.
,D的名称是乙醇.(2)反应①③④的反应类型分别为水解反应(取代反应)、酯化反应(取代反应)和消去反应
(3)除去F中杂质C、D时,最后要用分液的方法进行混和物的分离,F产物从分液漏斗的上口倒出 (填“上口倒出”或“下口放出”).
(4)写出反应②的反应方程式为
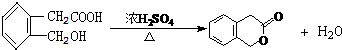 .
.
分析 由E的结构可推知B为 ,D的分子式为C2H6O,在浓硫酸、170℃条件下得到G(C2H4),则D为CH3CH2OH,G为CH2=CH2,C与F在浓硫酸、加热条件下得到F,结合F的分子式可知,F应为酯,故C为CH3COOH,F为CH3COOCH2CH3,A水解、酸化得到B、C、D,则A为
,D的分子式为C2H6O,在浓硫酸、170℃条件下得到G(C2H4),则D为CH3CH2OH,G为CH2=CH2,C与F在浓硫酸、加热条件下得到F,结合F的分子式可知,F应为酯,故C为CH3COOH,F为CH3COOCH2CH3,A水解、酸化得到B、C、D,则A为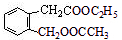 ,据此解答.
,据此解答.
解答 解:由E的结构可推知B为 ,D的分子式为C2H6O,在浓硫酸、170℃条件下发生消去反应得到G(C2H4),则D为CH3CH2OH,G为CH2=CH2,C与D在浓硫酸、加热条件下发生取代反应得到F,结合F的分子式可知,F应为酯,故C为CH3COOH,F为CH3COOCH2CH3,A水解、酸化得到B、C、D,则A为
,D的分子式为C2H6O,在浓硫酸、170℃条件下发生消去反应得到G(C2H4),则D为CH3CH2OH,G为CH2=CH2,C与D在浓硫酸、加热条件下发生取代反应得到F,结合F的分子式可知,F应为酯,故C为CH3COOH,F为CH3COOCH2CH3,A水解、酸化得到B、C、D,则A为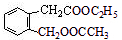 ,
,
(1)根据上面的分析可知,A为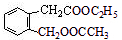 ,D为CH3CH2OH,D的名称是乙醇,
,D为CH3CH2OH,D的名称是乙醇,
故答案为: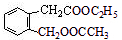 ;乙醇;
;乙醇;
(2)根据上面的分析可知,反应①为水解反应(取代反应),③为酯化反应(取代反应),④为消去反应,
故答案为:水解反应(取代反应);酯化反应(取代反应);消去反应;
(3)F为CH3COOCH2CH3,由于F的密度小于水,所以用分液的方法进行混和物的分离时,F产物从分液漏斗的上口倒出,
故答案为:上口倒出;
(4)反应②的反应方程式为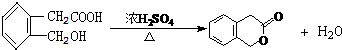 ,
,
故答案为: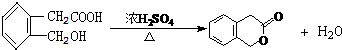 .
.
点评 本题考查有机物的推断,注意根据转化关系中E的结构以及D、G的分子式进行推断,掌握官能团的性质与转化是关键,难度中等.

练习册系列答案
相关题目
15.下列叙述正确的是( )
| A. | 固体时能导电的晶体一定为金属晶体 | |
| B. | 电负性差值小于1.7的A、B两种元素,组成的化合物也可能为离子化合物 | |
| C. | 某晶体难溶于水、熔点高、固态不导电,熔化时导电,可判断该晶体为离子晶体 | |
| D. | 由原子构成的晶体均具有熔沸点高、硬度大的特性 |
19.碱金属(如锂、钠、钾、铷等)溶于汞中形成良好的还原剂“汞齐”.取某种碱金属的汞齐7g,与足量水作用得到0.2g氢气,并得到密度为ρ•cm-3的溶液1L,则溶液中溶质的质量分数可能是( )
| A. | ($\frac{0.8}{ρ}$)% | B. | ($\frac{0.48}{ρ}$)% | C. | ($\frac{0.32}{ρ}$)% | D. | ($\frac{0.7}{ρ}$)% |
9.在由5种基团-CH3、-OH、-CHO、-C6H5、-COOH两两组成的物质中,能与NaOH反应的有机物有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
16.下列实验用来证明SO2的存在,其中正确的是( )
| A. | 不能使品红褪色 | |
| B. | 能使湿润的蓝色石蕊试纸变红 | |
| C. | 通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 | |
| D. | 通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸 |
14.某氢氧燃烧电池的电解质溶液为KOH溶液,下列有关该电池的叙述正确的是( )
| A. | 电池工作时,OH-向正极移动 | |
| B. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 工作一段时间后,电解质溶液的PH变大 | |
| D. | 用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mole-转移 |
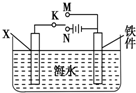 对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
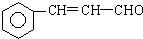 +5H2$\stackrel{一定条件下}{→}$
+5H2$\stackrel{一定条件下}{→}$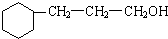 .
.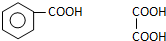 .
.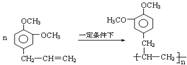 .
.