题目内容
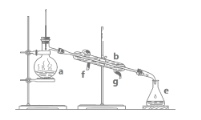
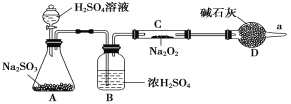
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,难溶于冷水,易溶于酸。其制备装置及步骤如下:
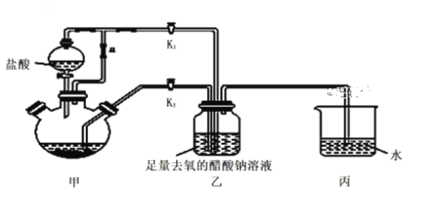
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到3.76 g [Cr(CH3COO)2]2·2H2O
(1)三颈烧瓶中的Zn与盐酸生成H2的作用____________,还发生的另一个反应的离子方程式为______________。
(2)实现步骤③中溶液自动转移至装置乙中的实验操作为______________,当乙中析出红棕色沉淀,为使沉淀充分析出并分离,需采用的操作是___________ 、_________、洗涤、干燥。
(3)装置丙中导管口水封的目的是______________。
(4)若实验所取用的CrCl3溶液中含溶质6.34 g,则[Cr(CH3COO)2]2·2H2O (相对分子质量为376)的产率是_______________________。
【答案】排除装置中的空气 2Cr3++Zn=2Cr2++Zn2+ 关闭K1,打开K2 冷却 过滤 防止空气进入装置乙中氧化Cr2+ 50%
【解析】
(1)根据题干信息,醋酸亚铬水合物易被氧化,三颈烧瓶中的Zn与盐酸生成H2可将装置内的空气排干净,防止其被氧化;装置甲分液漏斗盛装稀盐酸,在圆底烧瓶中和锌反应Zn+2HCl═ZnCl2+H2↑,同时发生2CrCl3+Zn═2CrCl2+ZnCl2,该反应的离子反应为:2Cr3++Zn═2Cr2++Zn2+;
答案为:排除装置中的空气;2Cr3++Zn=2Cr2++Zn2+
(2)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开K2关闭K1,把生成的CrCl2溶液压入装置乙中反应;醋酸亚铬水合物难溶于冷水,当乙中析出红棕色沉淀,为使沉淀充分析出并分离,先将装置乙冷却至室温,使其充分结晶析出,在用过滤的方法分离;
答案为:关闭K1,打开K2;冷却;过滤;
(3)Cr2+不稳定,极易被氧气氧化,装置丙中导管口水封的目的是避免空气进入装置乙氧化Cr2+;
故答案为:避免空气进入装置乙氧化Cr2+;
(4)CrCl3物质的量为![]() =0.04mol,得到CrCl2为0.04mol,根据原子守恒,则得到[Cr(CH3COO)2]2·2H2O为0.04mol,质量为0.04mol×1/2×376g/mol=7.52g,所得产品的产率为
=0.04mol,得到CrCl2为0.04mol,根据原子守恒,则得到[Cr(CH3COO)2]2·2H2O为0.04mol,质量为0.04mol×1/2×376g/mol=7.52g,所得产品的产率为![]() ×100%=50%;
×100%=50%;
故答案为:50%。

 英才计划期末调研系列答案
英才计划期末调研系列答案