题目内容
5.200ml Fe2(SO4)3溶液中Fe3+的浓度5mol/L,溶液中SO42-的物质的量浓度是( )| A. | 5mol/L | B. | 7.5 mol/L | C. | 10 mol/L | D. | 2.5 mol/L |
分析 根据硫酸铁的化学式及铁离子的浓度可知:c(SO42-)=$\frac{3}{2}$c(Fe3+),据此计算出溶液中SO42-的物质的量浓度.
解答 解:Fe2(SO4)3溶液中Fe3+的浓度5mol/L,
根据化学式Fe2(SO4)3组成可知,溶液中SO42-的物质的量浓度是:c(SO42-)=$\frac{3}{2}$c(Fe3+)=5mol/L×$\frac{3}{2}$=7.6mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意掌握溶质化学式与各离子之间的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
10.雷雨天闪电时空气中有臭氧(O3)生成,下列说法中正确的是( )
| A. | O2和O3互为同素异形体 | |
| B. | O3是由3个氧原子构成的化合物 | |
| C. | O2和O3相互转化属于化学变化 | |
| D. | 等质量的O2和O3含有的氧原子数相同 |
14.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 27 g铝原子最外层电子数为2NA | |
| B. | 2.4g镁与足量盐酸反应转移的电子数为0.1NA | |
| C. | 1 molH2O分子所含电子数为10NA | |
| D. | 标准状况下,22.4 L乙醇的分子数为NA |
15.针对如图所示的乙醇分子结构,下述关于乙醇在各种化学反应中化学键断裂情况的说法不正确的是( )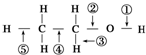
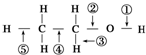
| A. | 与醋酸、浓硫酸共热发生酯化反应时,②键断裂 | |
| B. | 与金属钠反应时,①键断裂 | |
| C. | 与浓硫酸共热至170℃时,②、④键断裂 | |
| D. | 在加热和Ag催化下与O2反应时,①、③键断裂 |
 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理基污染是环境化学当前的重要研究内容之一.
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理基污染是环境化学当前的重要研究内容之一.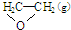 ),但是伴随副反应
),但是伴随副反应 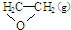 △H1
△H1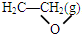 +$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1.
+$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1.