题目内容
8.如果已知100个氧分子质量为m克,那么阿伏加德罗常数的值是( )| A. | $\frac{3200}{m}$ | B. | $\frac{32}{100m}$ | C. | 3200m | D. | $\frac{m}{3200}$ |
分析 根据n=$\frac{m}{M}$计算氧气分子物质的量,再根据N=nNA可以计算阿伏加德罗常数的值.
解答 解:mg氧气分子物质的量为:$\frac{mg}{32g/mol}$=$\frac{m}{32}$mol,
则:$\frac{m}{32}$mol×NAmol-1=100,
解得NA=$\frac{3200}{m}$,
故选:A.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算.

练习册系列答案
相关题目
3.将一定量Na2O、Na2O2、Al组成的混合物投入足量水中,再滴加2mol•L-1H2SO4100mL时产生沉淀最多,则混合物中Na2O和Na2O2的总物质的量为( )
| A. | 无法确定 | B. | 0.2mol | C. | 0.4mol | D. | 0.5mol |
13.设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 标准状况下,9克H2O 含有的分子数为0.5NA | |
| C. | 常温常压下,32g O2和O3的混合气体所含原子数为2NA | |
| D. | 1mol Fe和足量稀盐酸反应,铁失去的电子数为2NA |
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 遇Fe(CN)63-生成特征蓝色沉淀的溶液:Ca2+、Clˉ、ClOˉ、Fe3+ | |
| B. | 遇石蕊变红的溶液:Na+、NH4+、NO3ˉ、K+ | |
| C. | 通有足量NO2的溶液:K+、Na+、SO32ˉ、AlO2ˉ | |
| D. | 与铝反应产生大量氢气的溶液:Ba2+、HCO3ˉ、Iˉ、Fe2+ |
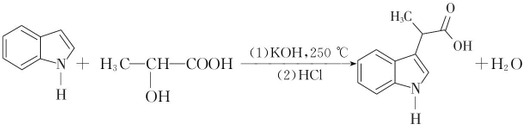
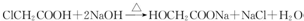 .
. .
. (填结构简式).
(填结构简式).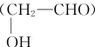 经如下步骤合成:
经如下步骤合成: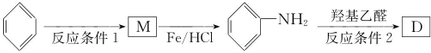
 的反应类型为还原反应,反应条件2为催化剂、加热,其反应的化学方程式为
的反应类型为还原反应,反应条件2为催化剂、加热,其反应的化学方程式为 .
.
 ;②中离子方程式为Br-+Ag+═AgBr↓;
;②中离子方程式为Br-+Ag+═AgBr↓;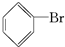 、Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤,洗涤后分离粗产品应使用的仪器是分液漏斗;
、Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤,洗涤后分离粗产品应使用的仪器是分液漏斗; ;
; 在有机物A分子中,具有酚羟基、醇羟基、羧基等官能团,其结构简式如图.
在有机物A分子中,具有酚羟基、醇羟基、羧基等官能团,其结构简式如图.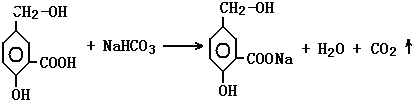 ;
; ;
;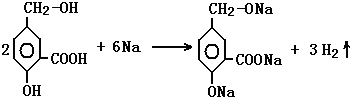 ;
; .
.