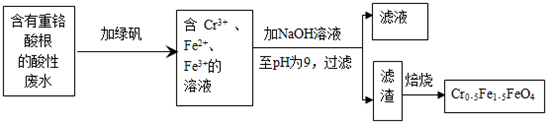
题目内容
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 遇Fe(CN)63-生成特征蓝色沉淀的溶液:Ca2+、Clˉ、ClOˉ、Fe3+ | |
| B. | 遇石蕊变红的溶液:Na+、NH4+、NO3ˉ、K+ | |
| C. | 通有足量NO2的溶液:K+、Na+、SO32ˉ、AlO2ˉ | |
| D. | 与铝反应产生大量氢气的溶液:Ba2+、HCO3ˉ、Iˉ、Fe2+ |
分析 A.遇Fe(CN)63-生成特征蓝色沉淀的溶液中存在亚铁离子,次氯酸根离子能够氧化亚铁离子;
B.遇石蕊变红的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
C.二氧化氮与水反应生成硝酸,硝酸能够与亚硫酸根离子、偏铝酸根离子反应;
D.与铝反应产生大量氢气的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子与亚铁离子发生双水解反应,碳酸氢根离子、亚铁离子都与氢氧根离子反应,碳酸氢根离子与氢离子反应.
解答 解:A.遇Fe(CN)63-生成特征蓝色沉淀的溶液中含有亚铁离子,ClO-具有强氧化性,能够氧化亚铁离子,在溶液中不能大量共存,故A错误;
B.遇石蕊变红的溶液为酸性溶液,溶液中存在大量氢离子,Na+、NH4+、NO3-、K+之间不反应,都不与氢离子反应,在溶液中能够大量共存,故B正确;
C.NO2与水反应生成硝酸,硝酸能够与SO32-、AlO2-反应,在溶液中不能大量共存,故C错误;
D.与铝反应产生大量氢气的溶液为酸性或碱性溶液,HCO3-与Fe2+发生双水解反应,且二者都与氢氧根离子反应,HCO3-与氢离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.如果已知100个氧分子质量为m克,那么阿伏加德罗常数的值是( )
| A. | $\frac{3200}{m}$ | B. | $\frac{32}{100m}$ | C. | 3200m | D. | $\frac{m}{3200}$ |
9.下列图示中关于铜电极的连接错误的是( )
| A. | 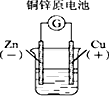 稀硫酸 | B. | 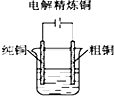 硫酸铜溶液 | C. | 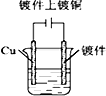 硫酸铜溶液 | D. | 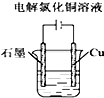 氯化铜溶液 |
6.请分析、比较以下几组化学反应,得出结论.
| 组别 | 化学方程式 | 结论 |
| I | 6CO2+6H2O═C6H12O6+6O2 CO2+H2O═H2CO3 | 反应物相同,生成物不同, 原因反应条件不同. |
| Ⅱ | Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O | 反应物相同,生成物不同, 原因反应物的浓度不同. |
| Ⅲ | C+O2(充足)$\frac{\underline{\;点燃\;}}{\;}$CO2 2C+O2(不充足)$\frac{\underline{\;点燃\;}}{\;}$2CO | 反应物相同,生成物不同, 原因反应物的量不同. |
| Ⅳ | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑(反应缓慢) 2KClO3 $→_{加热}^{二氧化锰}$2KCl+3O2↑(反应迅速) | 反应物相同,反应速率不同, 原因有无催化剂. |
| 实践与应用 | 科学探究正努力实现对化学反应的控制,很多化学家致力于研究二氧化碳的“组合转化”技术,把过多二氧化碳转化为有益于人类的物质.若让二氧化碳和氢气在一定条件下反应,可生成一种重要的化工原料,反应的化学方程式如下: 2CO2+6H2$\frac{\underline{\;催化剂\;}}{△}$X+4H2O,推断X的化学式是C2H4. | |
3.某溶液中含有NH4+、SO32-、SiO32-、Br -CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤溶液中共发生了2个氧化还原反应.
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤溶液中共发生了2个氧化还原反应.
| A. | ①②③④ | B. | ①②③④⑤ | C. | ①③④⑤ | D. | ②④⑤ |
10.砷为33号元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )
| A. | 砷在通常情况下是固体 | B. | 砷的还原性比磷弱 | ||
| C. | 可以存在-3、+3、+5等多种化合价 | D. | As2O5对应水化物的酸性比H3PO4弱 |
7.X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如表:
(1)Z位于元素周期表第三周期第IA族,其原子有11个电子.
(2)X单质的氧化性比Y单质的氧化性小(填“大”或“小”);X 最高价氧化物的电子式为: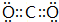 .
.
(3)写出含Z,Y两种元素的淡黄色化合物与XY2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
(4)与Z位于同周期且半径最小的金属元素的最高价氧化物的水化物能与Z的最高价氧化物的水化物反应,该反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y的原子最外层电子数为层数的3倍 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X单质的氧化性比Y单质的氧化性小(填“大”或“小”);X 最高价氧化物的电子式为:
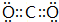 .
.(3)写出含Z,Y两种元素的淡黄色化合物与XY2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
(4)与Z位于同周期且半径最小的金属元素的最高价氧化物的水化物能与Z的最高价氧化物的水化物反应,该反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
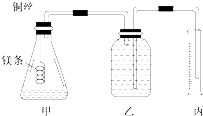 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下: