题目内容
3.将一定量Na2O、Na2O2、Al组成的混合物投入足量水中,再滴加2mol•L-1H2SO4100mL时产生沉淀最多,则混合物中Na2O和Na2O2的总物质的量为( )| A. | 无法确定 | B. | 0.2mol | C. | 0.4mol | D. | 0.5mol |
分析 当生成沉淀最多时,此时溶质为硫酸钠,根据n=cV计算出硫酸钠的物质的量,再根据化学式Na2O、Na2O2及钠离子守恒计算出氧化钠、过氧化钠的总物质的量.
解答 解:100mL 2mol•L-1H2SO4中含有硫酸的物质的量为:2mol/L×0.1L=0.2mol,
当生成沉淀最多时,此时溶质为硫酸钠,则生成硫酸钠的物质的量为0.2mol,含有0.4mol钠离子,
根据化学式Na2O、Na2O2可知,二者的化学式中都含有2个钠离子,则混合物中含有氧化钠和过氧化钠的总物质的量为:$\frac{0.4mol}{2}$=0.2mol,
故选B.
点评 本题考查了混合物反应的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
13.在无色透明的强酸性溶液中,下列各组离子能大量共存的是( )
| A. | NO3-、Cl-、Fe3+、K+ | B. | Cl-、Ag+、NO3-、Na+ | ||
| C. | SO42-、Al3+、Na+、Cl- | D. | NO3-、HCO3-、Na+、SO42- |
14.下列混合物分离(或除杂)的方法正确的是( )
| A. | Na2SO4溶液中混有少量CuSO4的杂质可用适量的KOH除去 | |
| B. | Na2CO3固体中含有少量NaHCO3杂质可用加热的方法提纯 | |
| C. | Fe(NO3)3中混有少量Fe(NO3)2的杂质可加入适量的氯水除去 | |
| D. | 可以用分液的方法分离CCl4和水 |
11.下列化合物中一定不含离子键的是( )
| A. | NaOH | B. | K2CO3 | C. | Na2O | D. | H2SO4 |
18.一定条件下,在某容积固定的密闭容器中进行反应:2SO2 (g)+O2(g)?2SO3(g).下列说法中,可以说明反应达到化学平衡状态的是( )
| A. | O2完全转化为SO3 | |
| B. | SO2、O2、SO3同时存在 | |
| C. | SO2、O2与SO3的浓度不再随时间变化 | |
| D. | SO2、O2与SO3的物质的量之比为2:1:2 |
8.如果已知100个氧分子质量为m克,那么阿伏加德罗常数的值是( )
| A. | $\frac{3200}{m}$ | B. | $\frac{32}{100m}$ | C. | 3200m | D. | $\frac{m}{3200}$ |
15.将50g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到Vml水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液.下列说法中正确的是( )
| A. | 若c1=2c2,则w1<2w2,V<50 mL | B. | 若c1=2c2,则w1<2w2,V>50 mL | ||
| C. | 若w1=2w2,则c1<2c2,V=50 mL | D. | 若w1=2w2,则c1>2c2,V<50 mL |
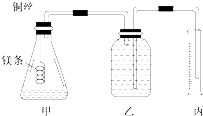 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下: