题目内容
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液。则消耗的O2的物质的量是 ,
消耗的HNO3的物质的量是
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L
(不考虑NO2转化成N2O4)。则消耗的HNO3的物质的量是 mol。
为消除污染,将生成的气体通入水中并同时通入O2,使生成的气体完全溶于水,则消耗O2的物质的量是 mol;若将生成的气体通入NaOH溶液中,气体被完全吸收,产物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量是 mol。
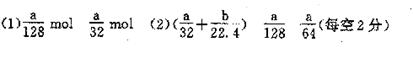
本题考查电子守恒和元素守恒,属中等难度。(1)n(O2)=ag/[64g·mol-1×2]= a/128mol
n(HNO3)="2" n(Cu)= 2ag/64g·mol-1=a/32mol 。(2)利用氮元素守恒,可得消耗的HNO3的物质的量(a/32 +b/22.4)mol,再利用a g Cu失去的电子数与O2得到的电子数相等,可得消耗O2的物质的量是n(O2)=a/128mol。若直接通入NaOH溶液中气体被完全吸收,产物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量可利用电子守恒得出。n(NaNO2)= ag/64g·mol-1=a/64mol。
n(HNO3)="2" n(Cu)= 2ag/64g·mol-1=a/32mol 。(2)利用氮元素守恒,可得消耗的HNO3的物质的量(a/32 +b/22.4)mol,再利用a g Cu失去的电子数与O2得到的电子数相等,可得消耗O2的物质的量是n(O2)=a/128mol。若直接通入NaOH溶液中气体被完全吸收,产物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量可利用电子守恒得出。n(NaNO2)= ag/64g·mol-1=a/64mol。

练习册系列答案
相关题目