题目内容
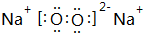
4.X、Y、Z、D、E、F是原子序数依次增大的六种常见元素.E的单质在Z2中燃烧的产物可使品红溶液褪色.F和Z元素形成的化合物F3Z4具有磁性.X的单质在Z2中燃烧可生成XZ和XZ2两种气体.D的单质是一种金属,该金属在XZ2中剧烈燃烧生成黑、白两种固体.请回答下列问题:(1)F元素在周期表中的位置是第4周期第Ⅷ族,Y的单质分子的结构式为N≡N,DZ的电子式为
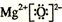 .
.(2)X元素形成的同素异形体的晶体类型可能是(填序号)①④.
①原子晶体 ②离子晶体 ③金属晶体 ④分子晶体
(3)X、Y、Z形成的10电子氢化物中,X、Y的氢化物沸点较低的是(写化学式):CH4;Y、Z的氢化物分子结合H+能力较强的是(写化学式)NH3.
分析 E的单质在Z2中燃烧的产物可使品红溶液褪色,该气体为SO2,则E为S元素,Z为O元素,F和Z元素形成的化合物F3Z4具有磁性,则F3Z4为Fe3O4,F为Fe元素,X的单质在Z2中燃烧可生成XZ和XZ2两种气体,X原子序数小于O元素,应为CO和CO2气体,X为C元素,D的单质是一种金属,该金属在XZ2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则D为Mg元素,Y的原子序数介于碳、氧之间,则Y为N元素,据此解答.
解答 解:E的单质在Z2中燃烧的产物可使品红溶液褪色,该气体为SO2,则E为S元素,Z为O元素,F和Z元素形成的化合物F3Z4具有磁性,则F3Z4为Fe3O4,F为Fe元素,X的单质在Z2中燃烧可生成XZ和XZ2两种气体,X原子序数小于O元素,应为CO和CO2气体,X为C元素,D的单质是一种金属,该金属在XZ2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则D为Mg元素,Y的原子序数介于碳、氧之间,则Y为N元素.
(1)F为Fe元素,在周期表中的位置是:第4周期第Ⅷ族,Y的单质分子为N2,结构式为N≡N,DZ为MgO,属于离子化合物,电子式为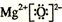 ,
,
故答案为:第4周期第Ⅷ族;N≡N;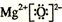 ;
;
(2)X为碳元素,碳元素形成的同素异形体有石墨、金刚石、C60等,金刚石属于原子晶体,C60属于分子晶体,故答案为:①④;
(3)C、N、O形成的10电子氢化物分别是CH4、NH3、H2O,氨气分子间存在氢键,导致氨气的沸点升高,甲烷中不含氢键,所以沸点较低的是CH4,氨气为碱性气体,NH3结合H+能力较强,用一个离子方程式加以证明:NH3+H3O+=NH4++H2O,
故答案为:CH4;NH3.
点评 本题考查结构性质位置关系综合应用,题目较为综合,关键是正确推断元素,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,非金属性最强的元素是F.(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al(填写元素符号),分别写出该元素的氢氧化物与⑥⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,Al(OH)3+KOH=KAlO2+2H2O.
(4)⑦和⑩元素形成单质的氧化性的强弱为Cl2>Br2.(用化学符号表示)证明该结论的一个实验事实(用离子方程式表示)Cl2+2Br-=2Cl-+Br2.
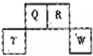 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )| A. | W在周期表中的位置是第三周期,ⅤA族 | |
| B. | 原子半径Q>R>T | |
| C. | W原子得电子能力强于Q原子,且可形成共价化合物QW2 | |
| D. | 原子序数比R多1的元素只有一种氢化物 |
| A. | 28Si、29Si、30Si是同素异形体 | |
| B. | 自然界里存在大量的单质硅、二氧化硅和硅酸盐 | |
| C. | 硅和锗都是重要的半导体材料 | |
| D. | 二氧化硅既溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物 |
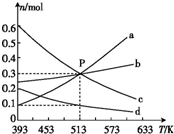 在1L恒容密闭容器中,发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H,平衡时各物质的物质的量与温度的关系如图所示,下列说法正确的是( )
在1L恒容密闭容器中,发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H,平衡时各物质的物质的量与温度的关系如图所示,下列说法正确的是( )| A. | △H<0 | |
| B. | 图中曲线a表示H2(g)的变化 | |
| C. | P点时,平衡常数值约为333.3 | |
| D. | 513 K时,向上述容器中充入n(H2)=0.6 mol,n(CO2)=0.2 mol,n(C2H4)=0.6 mol,n(H2O)=0.6 mol,则达到平衡时氢气的体积分数比P点时的小 |
| A. | 铁器 | B. | 石器 | C. | 青铜器 | D. | 合成材料 |
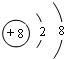 .
. ,X的A2B2型化合物的结构式是H-O-O-H.
,X的A2B2型化合物的结构式是H-O-O-H.