题目内容
11.X、Y、Z、W、R五种分属于不同主族的短周期元素,原子序数依次增大,X是空气中含量最多的元素;Y、Z、W的最高价氧化物的水化物可以两两相互反应.(1)R在周期表中的位置第三周期第ⅦA族;Z的原子结构示意图为
 .
.(2)W原子的核外电子排布式是1s22s22p63s23p4,在Z、W、R三原子中,未成对电子数最少的是Al、Cl(填元素符号)
(3)W的氢化物A的分子构型为V型; 与W同主族且半径比W小的元素所形成的氢化物B,A的沸点比B的沸点低(填“高”或“低”),原因是水分子之间有氢键.
(4)X的氢化物与其最高价氧化物的水化物等物质的量反应后,所生成的溶液中各离子浓度从大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(5)Y、Z能够形成合金,且该合金中Y、Z的质量比为23:27,如果将含lmolY的该合金置于足量水中充分反应,放出标况下气体44.8LL.
分析 X、Y、Z、W、R五种分属于不同主族的短周期元素,原子序数依次增大,X是空气中含量最多的元素,则X为N元素;Y、Z、W的最高价氧化物的水化物可以两两相互反应,应是氢氧化铝与强碱、强酸的反应,结合原子序数可推知Y为Na、Z为Al、W为S、R为Cl,据此解答.
解答 解:X、Y、Z、W、R五种分属于不同主族的短周期元素,原子序数依次增大,X是空气中含量最多的元素,则X为N元素;Y、Z、W的最高价氧化物的水化物可以两两相互反应,应是氢氧化铝与强碱、强酸的反应,结合原子序数可推知Y为Na、Z为Al、W为S、R为Cl,
(1)R为Cl,R在周期表中的位置第三周期第ⅦA族,Z为Al,Z的原子结构示意图为 ,
,
故答案为:第三周期第ⅦA族; ;
;
(2)W为S,W原子的核外电子排布式是1s22s22p63s23p4,Al原子中未成对电子数为1,S原子中未成对电子数为2,Cl原子中未成对电子数为1,所以三原子中,未成对电子数最少的是Cl,
故答案为:1s22s22p63s23p4;Al、Cl;
(3)W为S,W的氢化物A的分子为H2S,分子构型为V型,与W同主族且半径比W小的元素所形成的氢化物B为H2O,水的沸点比硫化氢高,是因为水分子之间有氢键,故答案为:V型;低;水分子之间有氢键;
(4)X为N,X的氢化物与其最高价氧化物的水化物等物质的量反应后生成NH4NO3,NH4NO3溶液中由于铵根离子水解生成氢氧根离子和氨水,所以溶液中各离子浓度从大到小的顺序是 c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(5)Na、Al能够形成合金,且该合金中Na、Al的质量比为23:27,则它们的物质量之比为1:1,如果将含lmolNa的该合金置于足量水中充分反应,生成1molNaOH和0.5molH2,同时1molNaOH又与1molAl反应生成1.5molH2,所以反应中共放出标况下气体44.8L,
故答案为:44.8.
点评 本题考查结构性质位置关系应用,涉及核外电子排布、电离能、杂化轨道、分子空间结构、晶胞计算、根据方程式计算等,难度不大,推断元素是解题的关键,注意基础知识的掌握.

| A. | s区 | B. | p区 | C. | d 区 | D. | ds区 |

| A. | 原子半径大小为:B>A>C | B. | 核电荷数:D>C>B>A | ||
| C. | A与D形成的化合物均是离子键 | D. | 生成的氢化物的稳定性为:D>A>B |
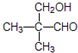
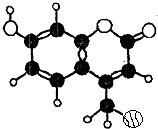 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )①该分子的核磁共振氢谱共有5种吸收峰
②能与溴水发生取代反应
③1mol该物质最多能与4molH2加成
④能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3mol NaOH的溶液反应.
| A. | ①②③ | B. | ③④⑤ | C. | ②③④ | D. | ②③④⑤ |
| A. | 混合气体的颜色不再变化 | |
| B. | O2、NO、NO2三种物质的反应速率之比为1:2:2 | |
| C. | 反应混合物中各组分物质的浓度相等 | |
| D. | 混合气体的密度不再改变 |

若在反应中消耗了1mol乙烷,则有关该反应的说法正确的是( )
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
| A. | 氮气 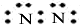 | B. | 氯化氢 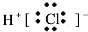 | C. | 氨气 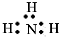 | D. | 氯化镁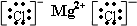 |
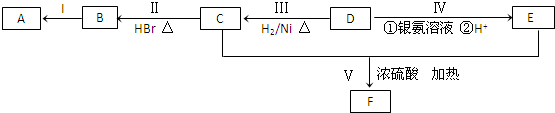
 .
. .
. ;②
;② 、
、 .
. (1)请指出锌电极和c电极的电极名称:(正、负、阴、阳)
(1)请指出锌电极和c电极的电极名称:(正、负、阴、阳)