题目内容
2.如图为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
| A. | 原子半径大小为:B>A>C | B. | 核电荷数:D>C>B>A | ||
| C. | A与D形成的化合物均是离子键 | D. | 生成的氢化物的稳定性为:D>A>B |
分析 这几种元素都是短周期元素,根据元素在周期表中的位置知,A、B、C、D分别是O、F、Ne、Cl元素,
A.同一周期元素,原子半径随着原子序数增大而减小,但稀有气体一般不作比较;
B.原子序数越大原子核电荷数越大;
C.A是O、D是Cl元素,非金属元素之间易形成共价键;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:这几种元素都是短周期元素,根据元素在周期表中的位置知,A、B、C、D分别是O、F、Ne、Cl元素,
A.同一周期元素,原子半径随着原子序数增大而减小,但稀有气体一般不作比较,故A错误;
B.原子序数越大原子核电荷数越大,原子序数D>C>B>A,所以核电荷数D>C>B>A,故B正确;
C.非金属元素之间易形成共价键,A是O、D是Cl元素,二者都是非金属元素,形成共价键,故C错误;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性B>A>D,所以氢化物的稳定性B>A>D,故D错误;
故选B.
点评 本题考查元素周期表和元素周期律综合应用,正确判断元素是解本题关键,熟悉元素周期律内涵,知道非金属性强弱与氢化物稳定性关系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列叙述正确的是( )
| A. | SiO2和CO2中,Si和O、C和O之间都是共价键 | |
| B. | 离子化合物中一定有金属元素 | |
| C. | 蛋白质溶液、淀粉溶液和蔗糖溶液都是胶体 | |
| D. | 共价化合物中各原子都满足8电子稳定结构 |
7.下列溶液一定呈中性的是( )
| A. | pH=7的溶液 | |
| B. | c(H+)=c(OH-)=10-6mol/L溶液 | |
| C. | c(H+)═10-7mol/L | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |
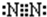 ;乙分子的结构式
;乙分子的结构式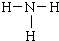 .
. .
.