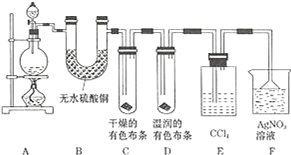
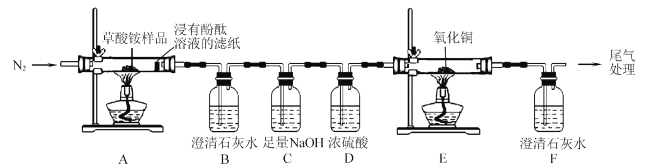
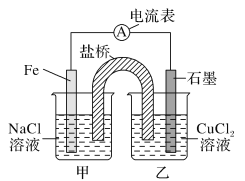
题目内容
【题目】已知某弱酸的酸式盐有NaH2XO4和Na2HXO4两种,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,NaH2XO4溶液和Na2HXO4溶液,二种溶液的浓度均为0.1mol·L-1,其中均存在的关系是( )
A.c(H+)·c(OH-)=1×10-14
B.c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-)
C.c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-)
D.c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-)
【答案】C
【解析】
NaH2XO4的溶液呈酸性,说明![]() 电离程度大于水解程度,Na2HXO4溶液呈碱性,说明
电离程度大于水解程度,Na2HXO4溶液呈碱性,说明![]() 水解程度大于电离程度,溶液中存在物料守恒,0.1molL-1NaH2XO4溶液中存在:c(Na+)=c(
水解程度大于电离程度,溶液中存在物料守恒,0.1molL-1NaH2XO4溶液中存在:c(Na+)=c(![]() )+c(
)+c(![]() )+c(
)+c(![]() )+c(H3XO4),Na2HXO4溶液中存在:c(Na+)=2c(
)+c(H3XO4),Na2HXO4溶液中存在:c(Na+)=2c(![]() )+2c(
)+2c(![]() )+2c(
)+2c(![]() )+2c(H3XO4),由溶液呈电中性原则可知,c(Na+)+c(H+)=c(
)+2c(H3XO4),由溶液呈电中性原则可知,c(Na+)+c(H+)=c(![]() )+c(OH-)+2c(
)+c(OH-)+2c(![]() )+3c(
)+3c(![]() ),结合物料守恒和电荷守恒联式比较,注意水的离子积常数与温度的关系。
),结合物料守恒和电荷守恒联式比较,注意水的离子积常数与温度的关系。
A.常温下c(H+)c(OH-)=1×10-14,温度升高,促进水的电离,水的离子积常数增大,则30℃时,c(H+)c(OH-)>1×10-14,故A错误;
B.溶液中存在物料守恒,0.1molL-1NaH2XO4溶液中存在:c(Na+)=c(![]() )+c(
)+c(![]() )+c(
)+c(![]() )+c(H3XO4),Na2HXO4溶液中存在:c(Na+)=2c(
)+c(H3XO4),Na2HXO4溶液中存在:c(Na+)=2c(![]() )+2c(
)+2c(![]() )+2c(
)+2c(![]() )+2c(H3XO4),由电中性原则可知,两种溶液中都存在:c(Na+)+c(H+)=c(
)+2c(H3XO4),由电中性原则可知,两种溶液中都存在:c(Na+)+c(H+)=c(![]() )+c(OH-)+2c(
)+c(OH-)+2c(![]() )+3c(
)+3c(![]() ),则有0.1molL-1NaH2XO4溶液中存在:c(H3XO4)+c(H+)=c(OH-)+c(
),则有0.1molL-1NaH2XO4溶液中存在:c(H3XO4)+c(H+)=c(OH-)+c(![]() )+2c(
)+2c(![]() ),Na2HXO4溶液中存在:c(
),Na2HXO4溶液中存在:c(![]() )+c(H+)+2c(H3XO4)=c(OH-)+c(
)+c(H+)+2c(H3XO4)=c(OH-)+c(![]() ),则只有Na2HXO4溶液中存在该关系,故B错误;
),则只有Na2HXO4溶液中存在该关系,故B错误;
C.由溶液呈电中性原则可知,溶液中阳离子所带电荷等于阴离子所带电荷,则c(Na+)+c(H+)=c(![]() )+c(OH-)+2c(
)+c(OH-)+2c(![]() )+3c(
)+3c(![]() ),故C正确;
),故C正确;
D.由B分析可知,只有0.1molL-1NaH2XO4溶液中存在该关系,故D错误;
故选C。

【题目】滴定实验是化学学科中重要的定量实验。请回答下列问题:
Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.00 g样品溶于水,配成250 mL溶液;
②准确量取25.00 mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.10 mol/L的盐酸标准液滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积mL | 所消耗盐酸标准液的体积/mL | |
滴定前读数 | 滴定后读数 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
(1)用__________滴定管(填“酸式”或“碱式”)盛装0.10 mol/L的盐酸标准液
(2)试样中NaOH的质量分数为__________
(3)若出现下列情况,测定结果偏高的是________
A.滴定前用蒸馏水冲洗锥形瓶
B.在振荡锥形瓶时不慎将瓶内溶液溅出
C.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
D.酸式滴定管滴至终点时,俯视读数
E.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定
(4)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1 mol·L-1的高锰酸钾溶液滴定,发生的反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时现象是__________
(5)用0.01 mol/L的I2标准溶液滴定未知浓度的Na2S2O3溶液,选用的指示剂是__________