题目内容
【题目】某校化学实验兴趣小组为了探究在实验室制备 Cl2 的过程中有水蒸气和 HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置 ( 支撑用的铁架台省略 ),按要求回答问题.
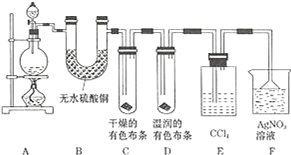
(1)下列方法中,可制得氯气的正确组合是___.(已知酸性条件下,K2Cr2O7、KClO3的氧化性均强于Cl2;酒精灯可以不用)
①MnO2 和浓盐酸混合共热; ②次氯酸钠和浓盐酸混合;③K2Cr2O7 和浓盐酸混合; ④KClO3 和浓盐酸混合共热;⑤KMnO4和浓盐酸混合;
A 只有① B 只有①⑤ C 只有①③④⑤ D 全部可以
(2)若用含有 0.2mol HCl 的浓盐酸与足量的 MnO2 反应制 Cl2,制得的 Cl2 体积 ( 标准状况下 )总是小于1.12L的原因是___.
(3)装置 B 的作用____,现象是____.
(4)装置 C 和 D 出现的不同现象说明的问题是___、装置 E 的作用是____.
(5)写出装置 F 中发生反应的离子方程式____.
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入 AgNO3 溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入 AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在__与__之间 ( 填装置字母序号 ),装置中应放入___.
【答案】D 浓盐酸的浓度随着反应的进行变稀以后,将不再反应;加热时浓盐酸因挥发而损失 证明有水蒸气产生 白色变蓝色 氯气无漂白性、次氯酸有漂白性 吸收氯气 Ag++Cl﹣=AgCl↓ E F 湿润的淀粉KI试纸(或湿润的有色布条)
【解析】
(1)利用强氧化剂氧化氯离子生成氯气;
(2)二氧化锰与浓盐酸反应,与稀盐酸不反应;
(3)硫酸铜吸水生成蓝色硫酸铜晶体,检验是否含有水蒸气;
(4)干燥的氯气不能使有色物质褪色,氯气不具有漂白性;氯气易溶于有机溶剂,四氯化碳吸收氯气,防止干扰F中氯化氢的检验;
(5)加入F中的气体为氯化氢,与硝酸银反应;
(6)氯气与水反应会生成盐酸,干扰F中氯化氢的检验,故在E、F之间用碘化钾淀粉试液检验氯气是否被完全吸收。
(1)①MnO2和浓盐酸混合共热,②MnO2、NaCl和浓硫酸混合共热,③次氯酸钠和浓盐酸混合,④KClO3和浓盐酸混合共热,⑤KMnO4和浓盐酸混和,都是实验室常用制备氯气的方法;
答案选D;
(2)浓盐酸与足量MnO2反应制取Cl2,反应需要加热,氯化氢易挥发,反应消耗氯化氢,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不反应不与MnO2反应,
故答案为:加热时浓盐酸因挥发而损失,随着反应的进行或挥发浓度变稀以后,将不再反应;
(3)硫酸铜吸水生成蓝色硫酸铜晶体,检验含有水蒸气,
故答案为:证明有水蒸气产生;白色固体变蓝色;
(4)干燥的有色布条不褪色,说明氯气不具有漂白性;湿润的有色布条褪色,氯气与水反应生成盐酸与次氯酸,盐酸不具有漂白性,所以使有色布条褪色的物质是次氯酸,故次氯酸漂白性,用四氯化碳吸收氯气,防止干扰F中氯化氢的检验,
故答案为:干燥氯气无漂白性,次氯酸有漂白性;吸收氯气;
(5)氯化氢与硝酸银反应生成氯化银和硝酸,反应离子方程式为Ag++Cl-=AgCl↓;
(6)氯气与水反应会生成盐酸,干扰F中氯化氢的检验,故在E、F之间加一装置,用湿润的淀粉碘化钾试纸或湿润的有色布条检验氯气是否被完全吸收,
故答案为:E F;湿润的淀粉KI试纸(或湿润的有色布条)。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案