题目内容
【题目】草酸铵[(NH4)2C2O4]为无色柱状晶体,不稳定,受热易分解,可用于测定Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。
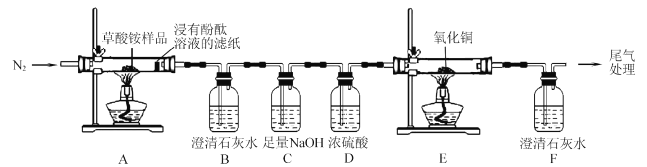
(l)实验过程中,观察到浸有酚酞溶液的滤纸变红,装置B中澄清石灰水变浑浊,说明分解产物中含有____(填化学式);若观察到____, 说明分解产物中含有CO2草酸铵分解的化学方程式为____。
(2)反应开始前,通人氮气的目的是____。
(3)装置C的作用是 ____。
(4)还有一种分解产物在一定条件下也能还原CuO,该反应的化学方程式为 _____。
Ⅱ.该同学利用草酸铵测定血液中钙元素的含量。
(5)取20. 00mL血液样品,定容至l00mL,分别取三份体积均为25. 00mL稀释后的血液样品,加入草酸铵,生成草酸钙沉淀,过滤,将该沉淀溶于过量稀硫酸中,然后用0. 0l00mol/LKMnO4溶液进行滴定。滴定至终点时的实验现象为____。三次滴定实验消耗KMnO4溶液的体积分别为0.43mL,0.4lmL,0.52mL,则该血液样品中钙元素的含量为__________ mmol/L。
【答案】NH3、CO2 E中黑色固体变红,F中澄清石灰水变浑浊 (NH4)2C2O4![]() 2NH3↑+CO2↑+CO↑+H2O 排尽装置中的空气 充分吸收CO2,防止干扰CO的检验 2NH3+3CuO
2NH3↑+CO2↑+CO↑+H2O 排尽装置中的空气 充分吸收CO2,防止干扰CO的检验 2NH3+3CuO![]() 3Cu+N2+3H2O 因最后一滴KMnO4溶液的滴入,溶液变为粉红色,且半分钟内不褪去 2.1
3Cu+N2+3H2O 因最后一滴KMnO4溶液的滴入,溶液变为粉红色,且半分钟内不褪去 2.1
【解析】
(l)按实验过程中观察到现象,推测分解产物并书写草酸铵分解的化学方程式;
(2) 氮气驱赶装置内原有气体,从空气对实验不利因素来分析;
(3)由所盛装的物质性质及实验目的推测装置C的作用;
(4)从分解产物中找到另一个有还原性的物质,结合氧化还原反应原理写该反应的化学方程式;
Ⅱ.(5)三次平行实验,计算时要数据处理,结合关系式进行计算;
(l)实验过程中,观察到浸有酚酞溶液的滤纸变为红色说明分解产物中含有氨气,装置B中澄清石灰水变浑浊,说明分解产物中含有二氧化碳气体;若观察到装置E中氧化铜由黑色变为红色,装置F中澄清石灰水变浑浊,说明分解产物中含有CO;
答案为:NH3;CO2 ; E中黑色固体变红,F中澄清石灰水变浑浊;
草酸铵分解产生了CO2、NH3、CO,结合质量守恒定律知,另有产物H2O,则草酸铵分解的化学方程式为(NH4)2C2O4![]() 2NH3↑+CO2↑+CO↑+H2O;
2NH3↑+CO2↑+CO↑+H2O;
答案为:(NH4)2C2O4![]() 2NH3↑+CO2↑+CO↑+H2O;
2NH3↑+CO2↑+CO↑+H2O;
(2)反应开始前,通人氮气的目的是排尽装置中的空气,避免CO与空气混合加热发生爆炸,并防止空气中的CO2干扰实验;
答案为:排尽装置中的空气;
(3) 装置E和F是验证草酸铵分解产物中含有CO,所以要依次把分解产生的CO2、气体中的水蒸气除去,所以装置C的作用是:吸收CO2,避免对CO的检验产生干扰;
答案为:充分吸收CO2,防止干扰CO的检验;
(4)还有一种分解产物在一定条件下也能还原CuO,那就是氨气,NH3也会与CuO反应,其产物是N2和水,该反应的化学方程式为2NH3+3CuO![]() 3Cu+N2+3H2O;
3Cu+N2+3H2O;
答案为:2NH3+3CuO![]() 3Cu+N2+3H2O;
3Cu+N2+3H2O;
(5)草酸钙沉淀溶于过量稀硫酸中得到草酸,用0. 0l00mol/LKMnO4溶液进行滴定,反应为![]() ,滴定至终点时,因最后一滴KMnO4溶液的滴入,溶液变为粉红色,且半分钟内不褪去;
,滴定至终点时,因最后一滴KMnO4溶液的滴入,溶液变为粉红色,且半分钟内不褪去;
答案为:因最后一滴KMnO4溶液的滴入,溶液变为粉红色,且半分钟内不褪去;
三次滴定实验消耗KMnO4溶液的体积分别为0.43mL,0.4lmL,0.52mL,应舍弃0.52mL,误差较大,则平均体积为0.42mL,滴定反应为![]() ,
,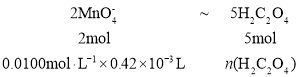 ;
; ![]() =1.05×105mol,所以20mL血液样品中含有的钙元素的物质的量为
=1.05×105mol,所以20mL血液样品中含有的钙元素的物质的量为![]() ,即4.2×102mmol,则该血液中钙元素的含量为
,即4.2×102mmol,则该血液中钙元素的含量为![]() ;
;
答案为:2.1。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D