题目内容
17. 往密闭容器中通入一定量N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深.如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律.X、Y分别是( )
往密闭容器中通入一定量N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深.如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律.X、Y分别是( )| A. | 温度T,逆反应速率υ逆 | B. | 温度T,气体的密度ρ | ||
| C. | 压强P,平衡常数K | D. | 压强P,N2O4转化率α |
分析 反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深,可以判断得出:此反应为吸热反应,且正反应方向为气体体积增大的反应,据此解答即可.
解答 解:A、温度升高,正、逆反应速率均增大,与图象不符,故A错误;
B、密闭容器,气体体积不变,气体的质量不变,故密度不变,故B错误;
C、平衡常数为温度的函数,与压强无关,故C错误;
D、增大压强,平衡左移,N2O4转化率α降低,与图象一致,故D正确,
故选D.
点评 本题考查化学反应速率、平衡移动原理及其应用,题目难度中等,注意分析反应的特点,从而判断温度和压强对平衡移动的影响是关键.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
8.常温下,下列有关叙述正确的是( )
| A. | 0.1 mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH均为11的下列溶液:①NaOH ②KHCO3③CH3COONa,其浓度大小:①>③>② | |
| D. | 常温下NaB溶液的pH=8,则c(Na+)-c(B-)=9.9×10-7 mol/L |
5.下列仪器的使用、实验药品选择或实验结果正确的是( )
| A. | 分液漏斗中盛放液体的总体积不得超过其容量的$\frac{2}{3}$ | |
| B. | 某学生用广泛pH试纸测得某溶液的pH为0 | |
| C. | 实验室制取乙酸乙酯用稀硫酸做催化剂效果会更好 | |
| D. | 焰色反应实验,所用铂丝先用盐酸洗涤并在酒精灯火焰上灼烧 |
12.下列关于有机物的说法中,正确的是( )
| A. | 油脂和蛋白质都是天然高分子化合物,都能水解 | |
| B. | 天然气和液化石油气的主要成分都是烃,都能燃烧 | |
| C. | 苯和乙烯都含有碳碳双键,都能和H2发生加成反应 | |
| D. | 裂化汽油和四氯化碳都不溶于水,都可用于萃取溴 |
2.X、Y、Z、W是四种短周期元素,X-和Y+具有相同的电子层结构,Z的一种核素在考古时常用来鉴定一些文物的年代,W可形成两种常见的液态氢化物.下列说法正确的是( )
| A. | Y在空气中燃烧一定生成Y2O2 | B. | Z只能形成两种含氧酸根 | ||
| C. | X-半径一定比Y+半径大 | D. | W 的氢化物一定比Z的氢化物稳定 |
9.如图所示装置,通入空气,开启a,b两个活塞,灼热铜丝,下列有关分析正确的是( )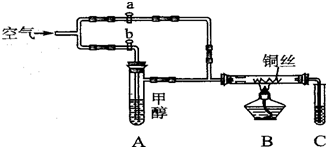

| A. | 灼热铜丝发生的现象变化为紫红色与黑色交替出现,甲醇发生还原反应 | |
| B. | C中有机产物易溶于水,与水分子间只形成1种氢键 | |
| C. | 检验C中产物的试剂可用1 mol•L-1的CuS04溶液2 mL和O.4 mol•L-1的NaOH溶液4 mL混合得到 | |
| D. | 可用酸性高锰酸钾溶液检验产物生成 |
6.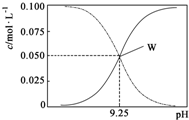 25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
 25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )| A. | W点表示溶液中:c(NH4+)+c(H+)=c(OH-) | |
| B. | pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3•H2O)<0.1 mol•L-1 | |
| C. | pH=9.5溶液中:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+) |
7.下列离子方程式书写正确的是( )
| A. | 用石灰乳吸收氯气:2Cl2+2OH-=2Cl-+2ClO-+H2O | |
| B. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=4OH-+2I2 | |
| C. | 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+13H+=4Cr3++11H2O+3CH3COO- | |
| D. | 碳酸氢铵与足量的氢氧化钙溶液反应:HCO3-+NH4++2OH-=NH3•H2O+H2O+CO32- |