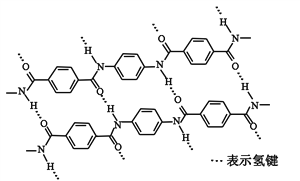
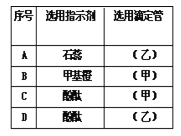
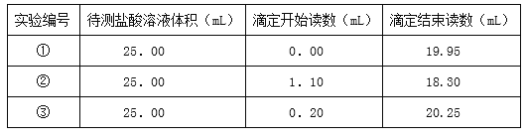
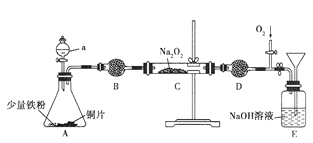
题目内容
【题目】10mL1mol·L-1的盐酸与过量的锌粉反应,若加入少量的下列物质,能减慢反应速率但又不影响氢气生成量的是
A.CuSO4(s)B.CH3COONa(s)C.KNO3(aq)D.Na2CO3(aq)
【答案】B
【解析】
A.加入少量硫酸铜后,Zn会置换出铜单质,生成的铜单质和锌构成原电池,会让反应速率加快,A项错误;
B.加入醋酸钠后,一部分盐酸转化为醋酸,醋酸属于弱酸,所以导致溶液中c(H+)下降,反应速率下降,但生成氢气的总量不会发生变化,B项正确;
C.加入硝酸钾后,![]() 和H+一同与Zn单质反应生成氮的还原产物,导致氢气的生成量减少,C项错误;
和H+一同与Zn单质反应生成氮的还原产物,导致氢气的生成量减少,C项错误;
D.加入碳酸钠后,![]() 也会消耗H+,导致氢气的生成量下降,D项错误;
也会消耗H+,导致氢气的生成量下降,D项错误;
答案选B。

练习册系列答案
相关题目