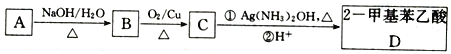
题目内容
【题目】NO具有还原性,不与碱反应,可以被过氧化钠吸收。某化学兴趣小组为了研究NO与Na2O2反应,通过如图所示装置进行实验。
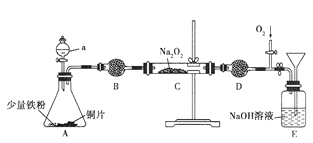
(1)仪器B的名称是_________________,其中填充的是___________________,作用为___________________________________________________________。
(2)从分液漏斗中加稀硝酸之前,先加入少量稀硫酸,目的是__________________。
(3)实验观察到C中固体颜色变白,该兴趣小组通过进一步实验证明C中生成的白色固体为NaNO2, C中反应的化学方程式为_______________________________。
(4)实验开始后需打开活塞,通入氧气,E中观察到的主要现象为_______________;NaOH溶液的作用是____________________________,若最终E中溶液只有一种溶质,发生的总反应方程式是___________________________________________________。
【答案】干燥管 碱石灰 避免 A中挥发出的水蒸气和硝酸蒸气进入C管与Na2O2反应,干扰实验 产生H2来排出装置中的空气,避免生成的NO与O2反应 2NO+Na2O2=2NaNO2 气体先变红棕色,最终又变无色 吸收处理尾气 4NO+3O2+4NaOH=4NaNO3+2H2O
【解析】
装置A中铜片和少量铁粉在分液漏斗中加稀硝酸之前,先加入少量稀硫酸让A中铁粉完全溶解生成氢气,利用产生H2来排出装置中的空气,再加入稀硝酸和铜发生氧化还原反应生成一氧化氮气体,通过碱石灰吸收水蒸气和硝酸蒸气,得到干燥纯净的一氧化氮与过氧化钠发生反应,装置D是避免E中水蒸气进入C干扰验证结果,剩余气体通入装置E和氧气在水溶液中反应生成硝酸,据此进行解答。
(1)根据B的结构可知B为干燥管;为了避免 A中挥发出的水蒸气和硝酸蒸气进入C管与Na2O2反应干扰实验,所以要在B中加入碱石灰除去杂质气体,故答案为:干燥管;碱石灰;避免 A中挥发出的水蒸气和硝酸蒸气进入C管与Na2O2反应,干扰实验;
(2)根据分析可知先加入少量硫酸的作用是与铁粉反应生成氢气排出装置中的空气,故答案为:产生H2来排出装置中的空气,避免生成的NO与O2反应;
(3)C中固体颜色变白,说明过氧化钠与NO发生反应,产物为NaNO2,根据电子守恒和元素守恒可得方程式为:2NO+Na2O2=2NaNO2;
(4)通入氧气,氧气会与NO反应生成NO2为红棕色气体,之后二氧化氮和水反应生成硝酸和一氧化氮,气体又变为无色;尾气有毒需要NaOH溶液吸收;若最终E中溶液只有一种溶质,则该溶质为NaNO3,根据电子守恒和元素守恒可得方程式为4NO+3O2+4NaOH=4NaNO3+2H2O,故答案为:气体先变红棕色,最终又变无色;吸收处理尾气;4NO+3O2+4NaOH=4NaNO3+2H2O。

【题目】填写下列表格
序号 | 物质 | 分子数(用NA表示) | 质量/g | 物质的量/mol | 摩尔质量/g·mol-1 | 体积/标况 |
(1) | 氮气 | ___ | 14 | ___ | ___ | ___ |
(2) | H2SO4 | 3.01×1022 | ___ | ___ | ___ | 空 |
(3) | H2O | ___ | ___ | 0.5 | ___ | 空 |
(4) | Cl2 | ___ | ___ | ___ | ___ | 2.24L |