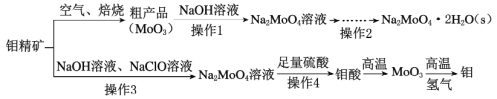
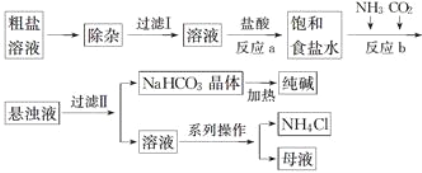
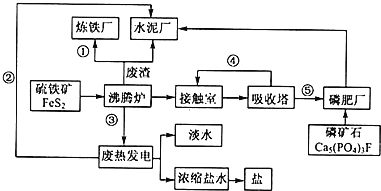
题目内容
【题目】某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液。
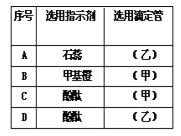
(1)该学生指示剂和装标准液的仪器选用正确的一组是___(写编号)

(2)该同学滴定操作的正确顺序是(用序号填写):( )→( )→d→( )→( )→( )→f___
a.用酸式滴定管取盐酸溶液25.00mL,注入锥形瓶中,加入指示剂
b.用蒸馏水洗干净滴定管
c.用待测定的溶液润洗酸式滴定管
d.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度"0"以上2~3 cm处,再把碱式滴定管固定好,调节液面至度"0"或“0”刻度以下
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
(3)实验中用左手控制___(填仪器及部位),眼睛注视__,直至滴定终点。判断到达终点的现象是__。
(4)已知滴定管中装有浓度为0.1000mol/L的氢氧化钠.逐滴加入到装有盐酸溶液的锥形瓶中。开始时读数及恰好反应时氢氧化钠溶液的读数见表。
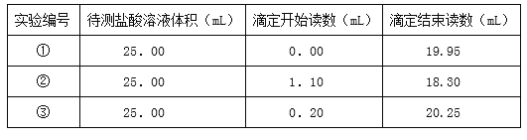
请计算待测的盐酸的物质的量浓度___。
(5)下面操作会导致待测盐酸的浓度偏大的是___(写编号)。
a.其它操作均正确,滴定终点读数时,仰视滴定管的刻度
b.盛装待测液的锥形瓶用水洗后未用所装待测液润洗
c.盛装标准液的碱式滴定管未用标准液洗
d.盛装待测液的酸式滴定管未用待测液润洗
e.配制标准溶液时,称取的NaOH固体中含少量KOH
【答案】D (e)→(b)→d→(c)→(a)→(g)→f 滴定管活塞 锥形瓶中溶液的颜色变化 当滴入最后一滴氢氧化钠溶液后,锥形瓶内最后溶液由无色突变为粉红色,且保持半分钟颜色不发生变化 0.0800mol/L ace
【解析】
(1)、氢氧化钠溶液应装在碱式滴定管中,一般不用石蕊作指示剂,强酸和强碱互滴,酚酞和甲基橙都可以,D中使用酚酞作指示剂和碱式滴定管,故选D。
(2)、用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液的顺序为:检查滴定管是否漏水,用蒸馏水洗干净滴定管,取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度"0"以上2~3cm处,再把碱式滴定管固定好,调节液面至"0"或“0”刻度以下,用待测定的溶液润洗酸式滴定管,用酸式滴定管取盐酸溶液25.00mL,注入锥形瓶中,加入指示剂,把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,另取锥形瓶,再重复操作一次。故答案为:(e)→(b)→d→(c)→(a)→(g)→f。
(3)、实验中用左手控制滴定管活塞,眼睛注视锥形瓶中溶液的颜色变化,直至滴定终点。判断到达终点的现象是当滴入最后一滴氢氧化钠溶液后,锥形瓶内最后溶液由无色突变为粉红色,且保持半分钟颜色不发生变化。故答案为:滴定管活塞;锥形瓶中溶液的颜色变化;当滴入最后一滴氢氧化钠溶液后,锥形瓶内最后溶液由无色突变为粉红色,且保持半分钟颜色不发生变化。
(4)、根据第①组数据知用盐酸的体积为:(19.95-0.00)mL=19.95mL,第②组数据知用盐酸的体积为:(18.30-1.10)mL=17.20mL,第③组数据知用盐酸的体积为:(20.25-0.20)mL=20.05mL,所以第②组数据误差较大,应舍去。所以平均用盐酸的体积为:(19.95+20.05)/2mL=20.00mL。待测的盐酸的物质的量浓度为:c(HCl)=![]() =
=![]() =0.0800mol/L;故答案为:0.0800mol/L
=0.0800mol/L;故答案为:0.0800mol/L
(5)、a.其它操作均正确,滴定终点读数时,仰视滴定管的刻度,读数偏大,即所用氢氧化钠溶液的体积偏大,导致待测盐酸的浓度偏大;
b.盛装待测液的锥形瓶用水洗后未用所装待测液润洗,不影响盐酸的中溶质的物质的量,不影响盐酸的浓度的测定;
c.盛装标准液的碱式滴定管未用标准液洗,使已知的氢氧化钠溶液的浓度减小,所用氢氧化钠溶液的体积偏大,导致待测盐酸的浓度偏大;
d.盛装待测液的酸式滴定管未用待测液润洗,使加入锥形瓶的盐酸的浓度减小,所用氢氧化钠溶液的体积偏小,导致待测盐酸的浓度偏小;
e.配制标准溶液时,称取的NaOH固体中含少量KOH,因为等质量的氢氧化钾消耗盐酸的物质的量较氢氧化钠少,所用氢氧化钠溶液的体积偏大,导致待测盐酸的浓度偏大。
故选:ace。