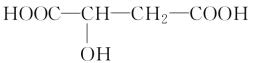题目内容
【题目】下列离子方程式不正确的是
A.过量SO2通入次氯酸钠溶液中:SO2+ClO-+H2O=SO42-+Cl-+2H+
B.二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O
C.实验室制备Cl2:![]()
D.酸性介质中KMnO4氧化H2O2:![]()
【答案】D
【解析】
A. 过量SO2通入次氯酸钠溶液中,反应生成硫酸和氯化钠,反应的离子方程式为:SO2+ClO-+H2O=SO42-+Cl-+2H+,选项A正确;
B. 二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,选项B正确;
C. 实验室利用二氧化锰和浓盐酸共热制备Cl2,反应的离子方程式为![]() ,选项C正确;
,选项C正确;
D. 酸性介质中KMnO4氧化H2O2,反应生成硫酸锰、硫酸钾、水和氧气,反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,选项D不正确;
答案选D。

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目