题目内容
【题目】烯烃催化裂解是制备短链烯烃的重要途径。研究表明,1-丁烯[CH3CH2CH=CH2(g)]催化裂解时,发生两个平行竞争反应生成丙烯和乙烯,两反应的热化学方程式为:
①3CH3CH2CH=CH2(g)![]() 4CH3CH=CH2(g) △H=+579 kJ·mol-1
4CH3CH=CH2(g) △H=+579 kJ·mol-1
②CH3CH2CH=CH2(g)![]() 2CH2=CH2(g) △H=+283 kJ·mol-1
2CH2=CH2(g) △H=+283 kJ·mol-1
回答下列问题:
(1)若1-丁烯的燃烧热为2539 kJ·mol-1,则表示乙烯燃烧热的热化学方程式为____;1-丁烯转化为丙烯反应的化学平衡常数表达式为_____。
(2)有利于提高1-丁烯平衡转化率的措施有_______。
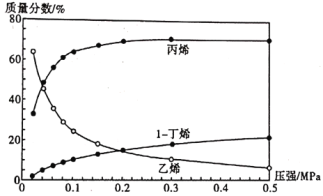
(3)550℃和0.02~0.5 MPa下,①②两个反应均建立平衡,测得平衡混合物里各组分的质量分数随压强变化的曲线如下图所示。由图可知,1-丁烯的质量分数随压强的增大而增大,主要原因是______。
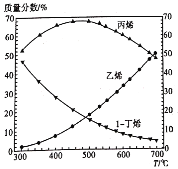
(4)在1-丁烯裂解的实际生产中,为了提高产物中丙烯的含量,除了选择合适的温度和压强之外,还有一条关键措施是_____。0.1 MPa和300~700℃下,1-丁烯裂解产物中各组分比例变化的曲线如下图所示。由图可知,生产过程中提高丙烯质量分数的最佳温度为___℃,在该温度之前各温度对应的组成______(填“一定是”、“可能是”或“一定不是”)平衡态,理由是____________。
【答案】CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l) △H= -1411kJ·mol-1 K=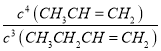 升高温度、减小压强 其它条件不变时,增大压强,CH3CH2CH=CH2催化裂解为丙烯或乙烯的平衡均逆向移动,CH3CH2CH=CH2的质量分数会增大 高选择性的催化剂 450℃ 可能是 1-丁烯裂解为丙烯和乙烯的反应均为吸热反应,升高温度,两个平衡均正向移动,导致丙烯和乙烯的质量分数增大
升高温度、减小压强 其它条件不变时,增大压强,CH3CH2CH=CH2催化裂解为丙烯或乙烯的平衡均逆向移动,CH3CH2CH=CH2的质量分数会增大 高选择性的催化剂 450℃ 可能是 1-丁烯裂解为丙烯和乙烯的反应均为吸热反应,升高温度,两个平衡均正向移动,导致丙烯和乙烯的质量分数增大
【解析】
(1)1-丁烯的燃烧热为2539 kJ·mol-1,则其燃烧热的热化学方程式为CH3CH2CH=CH2(g)+ 6O2(g)=4CO2(g)+4H2O(l)△H= -2539kJ·mol-1,结合盖斯定律写出乙烯燃烧热的热化学方程式;平衡常数等于生成物浓度幂的积与反应物浓度幂的积之比;
(2)改变温度、压强、反应物或生成物的浓度可促进平衡正向移动,提高反应物的转化率;
(3)可逆反应达到平衡后增大压强,平衡向气体总物质的量减小的方向移动;
(4)结合1-丁烯裂解过程中各裂解产物的含量与温度变化的曲线分析即可。
(1)已知:②CH3CH2CH=CH2(g)![]() 2CH2=CH2(g)△H=+283 kJ·mol-1,③CH3CH2CH=CH2(g)+ 6O2(g)=4CO2(g)+4H2O(l)△H= -2539kJ·mol-1,根据盖斯定律③
2CH2=CH2(g)△H=+283 kJ·mol-1,③CH3CH2CH=CH2(g)+ 6O2(g)=4CO2(g)+4H2O(l)△H= -2539kJ·mol-1,根据盖斯定律③![]() - ②
- ②![]() 可得CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l),则△H=(-2539kJ·mol-1)
可得CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l),则△H=(-2539kJ·mol-1)![]() -(+283 kJ·mol-1)
-(+283 kJ·mol-1)![]() =-1411kJ·mol-1,故乙烯燃烧热的热化学方程式为CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H= -1411kJ·mol-1;已知3CH3CH2CH=CH2(g)
=-1411kJ·mol-1,故乙烯燃烧热的热化学方程式为CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H= -1411kJ·mol-1;已知3CH3CH2CH=CH2(g)![]() 4CH3CH=CH2(g),则该反应的化学平衡常数表达式为K=
4CH3CH=CH2(g),则该反应的化学平衡常数表达式为K=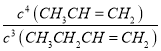 ;
;
(2)已知3CH3CH2CH=CH2(g)![]() 4CH3CH=CH2(g)△H=+579 kJ·mol-1,正反应为吸热、气体总物质的量增大的反应,则升高温度或减小压强可促进平衡正向移动,有利于提高1-丁烯平衡转化率;
4CH3CH=CH2(g)△H=+579 kJ·mol-1,正反应为吸热、气体总物质的量增大的反应,则升高温度或减小压强可促进平衡正向移动,有利于提高1-丁烯平衡转化率;
(3)已知:①3CH3CH2CH=CH2(g)![]() 4CH3CH=CH2(g)△H=+579 kJ·mol-1,②CH3CH2CH=CH2(g)
4CH3CH=CH2(g)△H=+579 kJ·mol-1,②CH3CH2CH=CH2(g)![]() 2CH2=CH2(g)△H=+283 kJ·mol-1,①②两个反应的逆反应均为气体总物质的量减小的反应,则其它条件不变时,增大压强,CH3CH2CH=CH2催化裂解为丙烯或乙烯的平衡均逆向移动,CH3CH2CH=CH2的质量分数会增大;
2CH2=CH2(g)△H=+283 kJ·mol-1,①②两个反应的逆反应均为气体总物质的量减小的反应,则其它条件不变时,增大压强,CH3CH2CH=CH2催化裂解为丙烯或乙烯的平衡均逆向移动,CH3CH2CH=CH2的质量分数会增大;
(4)已知:①3CH3CH2CH=CH2(g)4CH3CH=CH2(g)△H=+579 kJ·mol-1,②CH3CH2CH=CH2(g)
![]() 2CH2=CH2(g)△H=+283 kJ·mol-1,则生产过程中除选择合适的温度和压强之外,还需要选择高选择性的催化剂;由0.1 MPa和300~700℃下,1-丁烯裂解产物中各组分比例变化的曲线可知,生产过程中提高丙烯质量分数的最佳温度为450℃左右;1-丁烯裂解为丙烯和乙烯的反应均为吸热反应,升高温度,两个平衡均正向移动,导致丙烯和乙烯的质量分数增,则450℃之前各温度对应的组成可能是平衡态。
2CH2=CH2(g)△H=+283 kJ·mol-1,则生产过程中除选择合适的温度和压强之外,还需要选择高选择性的催化剂;由0.1 MPa和300~700℃下,1-丁烯裂解产物中各组分比例变化的曲线可知,生产过程中提高丙烯质量分数的最佳温度为450℃左右;1-丁烯裂解为丙烯和乙烯的反应均为吸热反应,升高温度,两个平衡均正向移动,导致丙烯和乙烯的质量分数增,则450℃之前各温度对应的组成可能是平衡态。

 名校课堂系列答案
名校课堂系列答案【题目】下列指定反应的化学用语表达正确的是( )
A | Mg(HCO3)2溶液与足量的NaOH溶液反应 | Mg2++2HCO |
B | 过量SO2通入到NaClO溶液中: | SO2+H2O+ClO-===HClO+ |
C | 向Al2(SO4)3溶液中加入过量的稀氨水 | Al3 ++4NH3·H2O=AlO2—+4NH4++2H2O |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO42﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D
【题目】据报道复旦大学修发贤教授课题组成功制备出砷化铌纳米带,并观测到其表面态具有百倍于金属铜薄膜和千倍于石墨烯的导电性。相关研究论文已在线发表于权威科学期刊《自然》。回答下列问题:
(1)铌元素(Nb)为一种金属元素,其基态原子的核外电子排布式为[Kr]4d55s1。下列是Nb的不同微粒的核外电子排布式,其中失去最外层1个电子所需能量最小的是___(填标号)。
a.[Kr]4d35s15p1b.[Kr]4d45s1c.Kr]4d2d.Kr]4d3
(2)砷为第VA族元素,砷可以与某些有机基团形成有机化合物,如(ClCH=CH)2AsCl,其中As原子与2个C原子、1个Cl原子形成的VSEPR模型为____。
(3)英国曼彻斯特大学物理学家安德烈·盖姆和康斯坦丁诺沃肖洛夫用微机械剥离法成功从石墨中分离出石墨烯,因此共同获得2010年诺贝尔物理学奖;而石墨烯具有优异的光学、电学、力学特性在材料学、微纳加工、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料。
已知“石墨烯”的平面结构如图所示,一定条件下石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子杂化类型是___,石墨烯导电的原因是____。

(4)石墨烯也可采用化学方法进行制备如采用六氯苯、六溴苯作为原料可制备石墨烯。下表给出了六氯苯、六溴苯、苯六酸俗名为蜜石酸的熔点和水溶性:
物质 | 六氯苯
| 六溴苯
| 苯六酸
|
熔点/℃ | 231 | 325 | 287 |
水溶性 | 不溶 | 不溶 | 易溶 |
六溴苯的熔点比六氯苯高的原因是____,苯六酸与六溴苯、六氯苯的水溶性存在明显的差异本质原因是___。
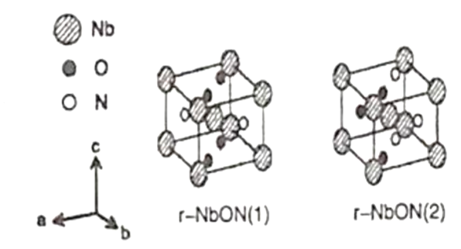
(5)出于以更高效率利用太阳光等目的研制出金红石型铌氧氮化物(NbON),比以往的光学半导体更能够吸收长波长侧的光,作为光学半导体的新材料。该化合物的晶胞有如图所示的两种构型,若晶胞的边长为apm,该晶体的密度为__g·cm-3。(NA是阿伏加德罗常数的值,相关原子量:Nb—93)
【题目】为探究Na与C02反应产物,某化学兴趣小组按如图装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3

回答下列问题:
(1)写出A中反应的离子方程式_____________________________________;
(2)仪器X的名称是____________________,B中的溶液为_____________________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g.再进行下列实验操作,其正确顺序是____________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入C02至E中出现浑浊 e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是______________________________________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
m1 | m2 | m3 |
66.7g | 69.0g | 72.lg |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____________________________________________。