��Ŀ����
����Ŀ���������һ�ֳ��õĻ��ʣ��乤ҵ����������ͼ����ش��������⡣
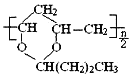
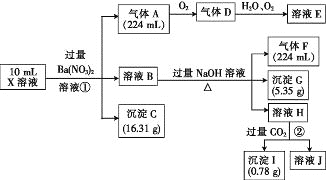
��1��д����Ӧ����B�з�����Ӧ�Ļ�ѧ����ʽ��____��
��2��������C��ͨ�������Ŀ����___��C��D������Ӧ�����з����ķ�Ӧ������������ԭ��Ӧ����___(�Ӧ��������)��
��3��Ũ����һ�㱣������ɫ�Լ�ƿ������������������û�ѧ����ʽ����ԭ��___��
��4��̼��Ũ���ᷴӦ�Ļ�ѧ����ʽ��_____��
��5����128gͭ����һ������Ũ�����в��ȡ���ͭƬ��ȫ��ʧʱ�����ռ���NO2��NO�Ļ������44.8L(��״��)��
��д�����������У��йط�Ӧ�����ӷ���ʽ��____��____��
����ɸ÷�Ӧ������Ҫ��ȡ10mol��L��1��Ũ����_____mL��
�ۻ��������NO2�����Ϊ____L��NO�����Ϊ____L(��Ϊ��״����)��
�ܽ��ռ��������������������ʢ��ˮ��ˮ���У��������л���ͨ��O2ʹ���ַ�Ӧ����Ҫʹ��Һǡ�ó�������������������Ҫ�μӷ�Ӧ��O2�����ʵ���Ϊ____mol��
���𰸡�4NH3��5O2![]() 4NO��6H2O ��һ�����������ɶ������� C 4HNO3
4NO��6H2O ��һ�����������ɶ������� C 4HNO3![]() 4NO2����O2����2H2O C��4HNO3(Ũ)
4NO2����O2����2H2O C��4HNO3(Ũ)![]() CO2����4NO2����2H2O Cu��4H����2NO3-=Cu2����2NO2����2H2O 3Cu��8H����2NO3-=3Cu2����2NO����4H2O 600 22.4 22.4 1
CO2����4NO2����2H2O Cu��4H����2NO3-=Cu2����2NO2����2H2O 3Cu��8H����2NO3-=3Cu2����2NO����4H2O 600 22.4 22.4 1
��������
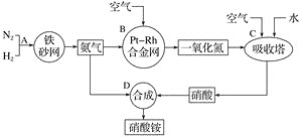
��1����Ӧ����B�а���������������Ӧ��
��2����������NO����������ΪNO2��������ˮ��Ӧ���������Ԫ�ػ��ϼ۱仯�ķ�Ӧ��������ԭ��Ӧ��
��3��Ũ��������ֽ⣻
��4��̼��Ũ���ᷴӦ���ɶ�����̼������������ˮ��
��5����ͭ��Ũ���ᷴӦ��������ͭ������������ˮ��ͭ��ϡ���ᷴӦ��������ͭ��һ��������ˮ��
�ڸ��ݵ�Ԫ���غ��������������
�۸��ݵ�ʧ�����غ����NO2��NO�������
�ܷ�Ӧ���������HNO3���ݹ��������̿�֪��ͭ�ṩ�ĵ��ӵ���������õĵ��ӣ��ݴ˼�����Ҫ���������ʵ�����
��1����Ӧ����B�а���������������Ӧ����NO��H2O����Ӧ����ʽ��4NH3��5O2![]() 4NO��6H2O��
4NO��6H2O��
��2����������NO����������ΪNO2�������������ᣬ����������C��ͨ�������Ŀ���ǽ�һ�����������ɶ�����������Ԫ�ػ��ϼ۱仯�ķ�Ӧ��������ԭ��Ӧ��C�з�����Ӧ4NO+3O2+2H2O=4HNO3��N��OԪ�ػ��ϼ۱仯������������ԭ��Ӧ��D�з�����ӦNH3+ HNO3=NH4NO3��Ԫ�ػ��ϼ۲��䣬���ڷ�������ԭ��Ӧ��
��3��Ũ������ⷢ���ֽⷴӦ4HNO3![]() 4NO2����O2����2H2O������Ũ����һ�㱣������ɫ�Լ�ƿ�����������������
4NO2����O2����2H2O������Ũ����һ�㱣������ɫ�Լ�ƿ�����������������
��4��̼��Ũ���ᷴӦ���ɶ�����̼������������ˮ����Ӧ����ʽ��C��4HNO3(Ũ)![]() CO2����4NO2����2H2O��
CO2����4NO2����2H2O��
��5����ͭ��Ũ���ᷴӦ��������ͭ������������ˮ����Ӧ�����ӷ���ʽ��Cu��4H����2NO3-=Cu2����2NO2����2H2O��ͭ��ϡ���ᷴӦ��������ͭ��һ��������ˮ����Ӧ�����ӷ���ʽ��3Cu��8H����2NO3-=3Cu2����2NO����4H2O��
��128gͭ�����ʵ�����![]() ������Cu(NO3)2~~~Cu2+~~~~~2NO3-���������Ե�����4mol�����ռ���NO2��NO�Ļ������44.8L(��״��)�����������Ե�����
������Cu(NO3)2~~~Cu2+~~~~~2NO3-���������Ե�����4mol�����ռ���NO2��NO�Ļ������44.8L(��״��)�����������Ե�����![]() �����Բμӷ�Ӧ�����Ṳ6mol��������������
�����Բμӷ�Ӧ�����Ṳ6mol��������������![]() =600 mL��
=600 mL��
����NO2�������xL����NO�������44.8L��xL�����ݵ�ʧ�����غ�n(NO2)��1+n(NO) ��3=n(Cu) ��2��![]() ��x=22.4L�����Ի��������NO2�����Ϊ22.4L��NO�����Ϊ22.4L(��Ϊ��״����)��
��x=22.4L�����Ի��������NO2�����Ϊ22.4L��NO�����Ϊ22.4L(��Ϊ��״����)��
�ܸ���ͭ�ṩ�ĵ��ӵ���������õĵ��ӽ�����ϵʽ2Cu~~O2��2molͭʧ����������1mol O2�õ�������������Ҫ�����������1mol��

 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�