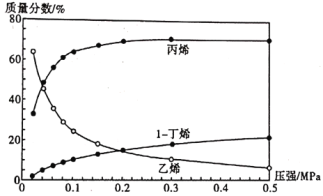
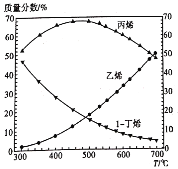
题目内容
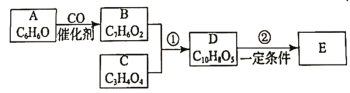
【题目】有机化合物E(![]() )是工业上合成一种锅炉防腐剂的中间体,合成路线如下:
)是工业上合成一种锅炉防腐剂的中间体,合成路线如下:
已知:
①R1CHO+R2CH2COOH![]() R1CH=C(R2)COOH+H2O(R1、R2为烃基或其它有机原子团)
R1CH=C(R2)COOH+H2O(R1、R2为烃基或其它有机原子团)
②RCH=C(COOH)2![]() RCH=CHCOOH+CO2
RCH=CHCOOH+CO2
③CH3CH=CH2+Cl2![]() ClCH2CH=CH2+HCl
ClCH2CH=CH2+HCl
回答下列问题:
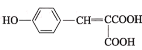
(1)有机物A的名称为________。1 mol有机物C与足量![]() 反应,能产生标准状下44.8 L
反应,能产生标准状下44.8 L ![]() ,写出C的结构简式:__________。
,写出C的结构简式:__________。
(2)有机物B中含有的官能团的名称为____________。比B多一个“![]() ”原子团的同系物M,满足下列条件的同分异构体有__________种,其中核磁共振氢谱为5组峰的结构简式为____________。①与氯化铁溶液混合成紫色;②能发生银镜反应
”原子团的同系物M,满足下列条件的同分异构体有__________种,其中核磁共振氢谱为5组峰的结构简式为____________。①与氯化铁溶液混合成紫色;②能发生银镜反应
(3)有机物D能发生的化学反应有_________(填写选项字母)。
A.加成反应 B.水解反应 C.氧化反应 D.消去反应
(4)写出反应①的化学方程式:__________________________
(5)根据题目信息,以丙烯为原料(其他无机试剂任选),设计制备化合物C的合成路线:______________
【答案】苯酚 ![]() 羟基、醛基 13
羟基、醛基 13 ![]() AC
AC ![]()
![]()
 +H2O CH3CH=CH2
+H2O CH3CH=CH2![]() ClCH2CH=CH2
ClCH2CH=CH2![]() ClCH2CH2CH2Cl
ClCH2CH2CH2Cl![]() HOCH2CH2CH2OH
HOCH2CH2CH2OH![]() OHCCH2CHO
OHCCH2CHO![]() HOOCCH2COOH
HOOCCH2COOH
【解析】
由E的结构简式为![]() ,结合信息②可知,D为
,结合信息②可知,D为![]() ;1 mol有机物C与足量NaHCO3反应,能产生标准状下44.8 LCO2,说明C中含有说明含有两个羧基,由D的结构简式和信息①,结合C的分子式可知,C为HOOCCH2COOH、B为
;1 mol有机物C与足量NaHCO3反应,能产生标准状下44.8 LCO2,说明C中含有说明含有两个羧基,由D的结构简式和信息①,结合C的分子式可知,C为HOOCCH2COOH、B为![]() ;由A和B的分子式可知,A为
;由A和B的分子式可知,A为![]() 。
。
(1)有机物A的结构简式为![]() ,名称为苯酚;由分析可知C的结构简式为HOOCCH2COOH,故答案为:苯酚;HOOCCH2COOH;
,名称为苯酚;由分析可知C的结构简式为HOOCCH2COOH,故答案为:苯酚;HOOCCH2COOH;
(2)有机物B的结构简式为![]() ,官能团为羟基、醛基;故答案为:羟基、醛基;比B多一个“
,官能团为羟基、醛基;故答案为:羟基、醛基;比B多一个“![]() ”原子团的同系物M的分子式为C8H8O2,M与氯化铁溶液混合呈紫色说明含有酚羟基,能发生银镜反应,说明含有醛基,若苯环上有2个侧链,侧链为—OH和—CH2CHO,根据苯环上有邻、间、对三个位置可知共有3种;若苯环上有3个侧链,侧链为—OH、—CHO和—CH3,—OH、—CHO在苯环上的同分异构体共有
”原子团的同系物M的分子式为C8H8O2,M与氯化铁溶液混合呈紫色说明含有酚羟基,能发生银镜反应,说明含有醛基,若苯环上有2个侧链,侧链为—OH和—CH2CHO,根据苯环上有邻、间、对三个位置可知共有3种;若苯环上有3个侧链,侧链为—OH、—CHO和—CH3,—OH、—CHO在苯环上的同分异构体共有![]() 、
、 和
和 3种,—CH3取代
3种,—CH3取代![]() 苯环上的氢原子有2种、取代
苯环上的氢原子有2种、取代 和
和 苯环上的氢原子各有4种,则符合条件的同分异构体共有13种;核磁共振氢谱为5组峰的结构简式为
苯环上的氢原子各有4种,则符合条件的同分异构体共有13种;核磁共振氢谱为5组峰的结构简式为![]() ,故答案为:13;
,故答案为:13;![]() ;
;
(3)有机物D的结构简式为![]() ,分子中含有苯环和碳碳双键,能和氢气等发生加成反应;分子中不含有酯基,不能发生水解反应;分子中含有酚羟基和碳碳双键,能发生氧化反应;羟基连接在苯环上,不能发生消去反应,则AC正确,故答案为:AC;
,分子中含有苯环和碳碳双键,能和氢气等发生加成反应;分子中不含有酯基,不能发生水解反应;分子中含有酚羟基和碳碳双键,能发生氧化反应;羟基连接在苯环上,不能发生消去反应,则AC正确,故答案为:AC;
(4)反应①为![]() 与HOOCCH2COOH发生信息①反应生成
与HOOCCH2COOH发生信息①反应生成![]() ,反应的化学方程式为
,反应的化学方程式为![]()
![]()
 +H2O,故答案为:
+H2O,故答案为:![]()
![]()
 +H2O;
+H2O;
(5)由HOOCCH2COOH的结构简式和信息③可知,合成HOOCCH2COOH的步骤为:一定条件下丙烯和氯气发生甲基上的取代反应生成ClCH2CH=CH2,ClCH2CH=CH2与氯化氢发生加成反应生成CICH2CH2CH2Cl,CICH2CH2CH2Cl在氢氧化钠溶液中共热发生水解反应生成HOCH2CH2CH2OH,在铜做催化剂作用下,HOCH2CH2CH2OH和氧气共热发生催化氧化反应生成OHCCH2CHO,在催化剂作用下,OHCCH2CHO和氧气共热发生催化氧化反应生成丙二酸,合成路线为CH3CH=CH2![]() ClCH2CH=CH2
ClCH2CH=CH2![]() ClCH2CH2CH2Cl
ClCH2CH2CH2Cl![]() HOCH2CH2CH2OH
HOCH2CH2CH2OH![]() OHCCH2CHO
OHCCH2CHO![]() HOOCCH2COOH,故答案为:CH3CH=CH2
HOOCCH2COOH,故答案为:CH3CH=CH2![]() ClCH2CH=CH2
ClCH2CH=CH2![]() ClCH2CH2CH2Cl
ClCH2CH2CH2Cl![]() HOCH2CH2CH2OH
HOCH2CH2CH2OH![]() OHCCH2CHO
OHCCH2CHO![]() HOOCCH2COOH。
HOOCCH2COOH。

【题目】一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是____________________________。
(2)推测A中可能含有的金属阳离子:①Fe3+;②只有Fe2+;③______。
甲同学为探究溶液的组成,实验如下:
实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
取少量溶液A于试管中,加入KSCN溶液。 | ________ | 假设②不成立,假设①或③成立;反应的离子方程式是_____________ 。 |
(3)乙同学继续探究溶液A的组成。
查阅资料:16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:另取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4紫色褪去。
实验结论:__________(填写字母序号)。
a.可能有Fe2+ b.可能无Fe2+ c.一定有Fe2+
(4)结论:A中含有的阳离子是_________,简述理由:________________。
【题目】实验小组研究二价铁的氧化反应,设计如下实验。
实验序号 | 试剂及操作 | 现象 |
Ⅰ |
| 现象a:生成白色沉淀,最终转变为红褐色 现象b:…… |
Ⅱ |
| 现象c:溶液略呈黄色 现象d:溶液呈红色 |
(1)实验所用的Fe(NO3)2溶液由Fe(NO3)3溶液和足量铁粉反应制得,离子方程式是___________________________________。
(2)实验I中白色沉淀转变为红褐色的化学方程式是______。
(3)现象b是______。
(4)实验小组对实验II中何种物质氧化Fe2+进行研究,提出两种假设:
i.酸性条件下,O2氧化了Fe2+
ii.酸性条件下, _______
①将假设ii补充完整。
②设计实验,证实了假设i 不是实验II中氧化Fe2+的主要原因。将实验方案和现象补充完整。
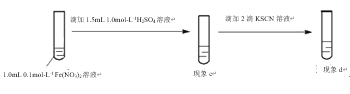
步骤1:向1.0 mL ______溶液中滴加1.5 mL 1.0 mol·L-1 H2SO4溶液;
步骤2:向上述所得溶液中滴加KSCN溶液,观察到______。
③向步骤2所得溶液中滴加NaOH溶液至pH约为5,检测到有Fe3+产生。
(5)综合上述实验,说明二价铁的氧化反应与______因素有关。