题目内容
如表为长式周期表的一部分,其中的序号代表对应的元素.

(1)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为 杂化,δ键与π键的个数比为 .
(2)元素③、④、⑤、⑥的第一电离能由大到小的顺序为 .其中⑥元素离子核外电子的电子排布图为 .
(3)③元素形成的最高价氧化物所形成的晶胞边长为a cm,则其晶胞密度为 ;
(4)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,还原产物没有气体,该反应的离子方程式为 .
(5)元素③与⑤形成的原子个数比为1:1化合物能与⑩的单质形成形式为A(BC)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,其晶体类型 ,该配合物在一定条件下分解生成⑩的单质和③与⑤形成的原子个数比为1:1化合物,则在分解过程中破坏的化学键为 ,形成的化学键为 .
(6)化学上有一种见解,认为同种元素形成的含氧酸中该成酸元素的化合价越高,酸性越强,请用表中的元素举例说明(酸性由强到弱的顺序) .

(1)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为
(2)元素③、④、⑤、⑥的第一电离能由大到小的顺序为
(3)③元素形成的最高价氧化物所形成的晶胞边长为a cm,则其晶胞密度为
(4)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,还原产物没有气体,该反应的离子方程式为
(5)元素③与⑤形成的原子个数比为1:1化合物能与⑩的单质形成形式为A(BC)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,其晶体类型
(6)化学上有一种见解,认为同种元素形成的含氧酸中该成酸元素的化合价越高,酸性越强,请用表中的元素举例说明(酸性由强到弱的顺序)
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置,可知①是H,②是Be,③是C,④是N,⑤是O,⑥是F,⑦是Mg,⑧是Cl,⑨是Cr,⑩是Fe.
(1)素③与①形成的水果催熟剂气体化合物为CH2=CH2;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
根据核外电子排布规律画出F元素离子核外电子的电子排布图;
(3)③元素形成的最高价氧化物为CO2,所形成的晶体晶胞中CO2处于顶点与面心,根据均摊法计算晶胞中CO2分子数目,进而计算晶胞质量与体积,再根据ρ=
计算;
(4)Mg与稀硝酸反应中还原产物没有气体,说明还原产物为硝酸铵,还生成硝酸镁与水;
(5)Fe(CO)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,应属于分子晶体;该配合物分解生成Fe与CO,Fe与CO之间形成配位键,金属Fe中存在金属性,故破坏配位键、形成金属键;
(6)利用氯元素含氧酸强弱解答.
(1)素③与①形成的水果催熟剂气体化合物为CH2=CH2;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
根据核外电子排布规律画出F元素离子核外电子的电子排布图;
(3)③元素形成的最高价氧化物为CO2,所形成的晶体晶胞中CO2处于顶点与面心,根据均摊法计算晶胞中CO2分子数目,进而计算晶胞质量与体积,再根据ρ=
| m |
| V |
(4)Mg与稀硝酸反应中还原产物没有气体,说明还原产物为硝酸铵,还生成硝酸镁与水;
(5)Fe(CO)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,应属于分子晶体;该配合物分解生成Fe与CO,Fe与CO之间形成配位键,金属Fe中存在金属性,故破坏配位键、形成金属键;
(6)利用氯元素含氧酸强弱解答.
解答:
解:根据元素在周期表中的位置,可知①是H,②是Be,③是C,④是N,⑤是O,⑥是F,⑦是Mg,⑧是Cl,⑨是Cr,⑩是Fe.
(1)素③与①形成的水果催熟剂气体化合物为CH2=CH2,C原子成3个δ键、没有孤电子对,杂化轨道数目为3,C原子采取sp2杂化,单键为δ键,双键含有1个δ键、1个π键,故分子中δ键与π键之比为5:1,
故答案为:sp2;5:1;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:F>N>O>C;
F元素离子原子核外电子数为10,F-离子核外电子排布图为 ,
,
故答案为:F>N>O>C; ;
;
(3)③元素形成的最高价氧化物为CO2,所形成的晶体晶胞中CO2处于顶点与面心,晶胞中CO2分子数目=8×
+6×
=4,晶胞质量=
g,晶胞体积=a3 cm3,故晶体密度=
=
g/cm3,
故答案为:
g/cm3;
(4)Mg与稀硝酸反应中还原产物没有气体,说明还原产物为硝酸铵,还生成硝酸镁与水,该反应的离子方程式为:4Mg+10H++NO3-=4Mg2++NH4++3H2O,
故答案为:4Mg+10H++NO3-=4Mg2++NH4++3H2O;
(5)Fe(CO)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,应属于分子晶体;该配合物分解生成Fe与CO,Fe与CO之间形成配位键,金属Fe中存在金属性,故破坏配位键、形成金属键,
故答案为:分子晶体;配位键;金属键;
(6)元素形成的含氧酸中该成酸元素的化合价越高,酸性越强,如:HClO4>HClO3>HClO2>HClO,
故答案为:HClO4>HClO3>HClO2>HClO.
(1)素③与①形成的水果催熟剂气体化合物为CH2=CH2,C原子成3个δ键、没有孤电子对,杂化轨道数目为3,C原子采取sp2杂化,单键为δ键,双键含有1个δ键、1个π键,故分子中δ键与π键之比为5:1,
故答案为:sp2;5:1;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:F>N>O>C;
F元素离子原子核外电子数为10,F-离子核外电子排布图为
 ,
,故答案为:F>N>O>C;
 ;
;(3)③元素形成的最高价氧化物为CO2,所形成的晶体晶胞中CO2处于顶点与面心,晶胞中CO2分子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4×44 |
| NA |
| ||
| a3cm3 |
| 176 |
| NAa3 |
故答案为:
| 176 |
| NAa3 |
(4)Mg与稀硝酸反应中还原产物没有气体,说明还原产物为硝酸铵,还生成硝酸镁与水,该反应的离子方程式为:4Mg+10H++NO3-=4Mg2++NH4++3H2O,
故答案为:4Mg+10H++NO3-=4Mg2++NH4++3H2O;
(5)Fe(CO)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,应属于分子晶体;该配合物分解生成Fe与CO,Fe与CO之间形成配位键,金属Fe中存在金属性,故破坏配位键、形成金属键,
故答案为:分子晶体;配位键;金属键;
(6)元素形成的含氧酸中该成酸元素的化合价越高,酸性越强,如:HClO4>HClO3>HClO2>HClO,
故答案为:HClO4>HClO3>HClO2>HClO.
点评:本题考查元素周期表与元素周期律综合应用,涉及杂化轨道、化学键、电离能、核外电子排布、晶胞计算、晶体类型与性质、酸性比较等,题目综合性较大,需要学生熟练掌握基础知识,(3)为易错点,学生对晶胞结构不清楚,注意识记中学常见晶胞结构,难度中等.

练习册系列答案
相关题目
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法错误的是( )
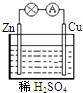

| A、溶液中H+向负极移动 |
| B、电子由Zn经外电路流向Cu |
| C、Zn电极反应:Zn-2e-=Zn2+ |
| D、Cu是正极 |
下列叙述中不正确的是( )
| A、离子晶体中可能含有共价键 |
| B、金属晶体都能导电 |
| C、分子晶体一定易溶于有机溶剂 |
| D、原子晶体中只含有共价键 |