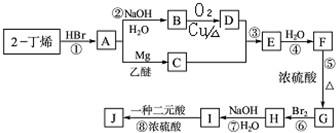
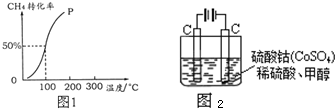
题目内容
将4g NaOH溶于 g水中,可使溶液中H2O与Na+的物质的量之比等于20:1,此溶液中溶质的质量分数为 ;若测得该溶液的密度为1.1g/cm3,则该溶液体积为 ( 保留一位小数),溶液中c(Na+)为 .
考点:物质的量的相关计算
专题:计算题
分析:根据n=
计算4gNaOH的物质的量,进而计算水的物质的量,根据m=nM计算水的质量,溶液的质量=m(水)+m(NaOH),溶液质量分数=
×100%,根据V=
计算溶液体积,根据c=
计算溶液中c(Na+).
| m |
| M |
| m(NaOH) |
| m(溶液) |
| m |
| ρ |
| n |
| V |
解答:
解:4gNaOH的物质的量=
=0.1mol,溶液中H2O与Na+的物质的量之比为20:1,则水的物质的量=0.1mol×20=2mol,
故水的质量为2mol×18g/mol=36g,
溶液的质量=m(水)+m(NaOH)=4g+36g=40g,故溶液质量分数=
×100%=10%,
溶液体积=
=36.4cm3,
溶液中c(Na+)=
=2.75mol/L
故答案为:36;10%;36.4cm3;2.75mol/L.
| 4g |
| 40g/mol |
故水的质量为2mol×18g/mol=36g,
溶液的质量=m(水)+m(NaOH)=4g+36g=40g,故溶液质量分数=
| 4g |
| 40g |
溶液体积=
| 40g |
| 1.1g/cm3 |
溶液中c(Na+)=
| 0.1mol |
| 0.0364L |
故答案为:36;10%;36.4cm3;2.75mol/L.
点评:本题考查物质的量的有关计算、溶液质量分数的计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
下列化学过程及其表述正确的是( )
| A、向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH═BaSO4↓+H2O |
| B、由水电离的c(H+)为10-3mol?L-1的溶液中,Na+、NO3-、SO32-、Cl-一定能大量共存 |
| C、向含有1mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol |
| D、可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以汪明H2O2具有还原性2MnO4+6H++5H2O2═2Mn2++5O2↑+8H2O |
把一小块钠放入下列溶液中,既能产生气体又会出现沉淀的是( )
| A、稀H2S04 |
| B、KOH稀溶液 |
| C、氯化铁溶液 |
| D、氯化钠溶液 |
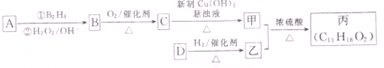
 右图是一个化学过程的示意图.已知甲池的总反应式为:
右图是一个化学过程的示意图.已知甲池的总反应式为: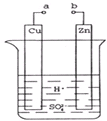 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献.