题目内容
【题目】(1)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是_______。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
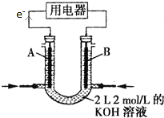
A处其电极反应式为___________;
(3)某元素的同位素![]() ,它的氯化物XCl21.11g溶于水配成溶液后,加入1mo1/L的AgNO3溶液20mL,恰好完全反应。若这种同位素的原子核内有20个中子,Z的值为_____,A的值为______。
,它的氯化物XCl21.11g溶于水配成溶液后,加入1mo1/L的AgNO3溶液20mL,恰好完全反应。若这种同位素的原子核内有20个中子,Z的值为_____,A的值为______。
(4)将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:
NH4Br(s)![]() NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g)![]() Br2(g)+H2(g)
Br2(g)+H2(g)
2min后,测知c(H2)=0.5mo/L,c(HBr)=4mol/L。若上述反应速率用v(NH3)表示,则v(NH3)=_____
【答案】 ② CH4-8e-+10OH-=CO32-+7H2O 20 40 2.5mol/(L·min)
【解析】(1)验证Fe3+与Cu2+氧化性强弱,在原电池中,铜作负极、其它导电的金属或非金属作正极,电解质溶液为可溶性的铁盐;
(2)根据电子流向知,A为负极、B为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
(3)根据硝酸银的物质的量计算氯离子的物质的量,进而计算氯化物的相对分子质量,最后计算X的质量数,结合A=Z+N计算和判断;
(4)根据v=△c/△t结合方程式计算。
(1)验证Fe3+与Cu2+氧化性强弱,在原电池中,铜作负极、其它导电的金属或非金属作正极,电解质溶液为可溶性的铁盐,则
①中铁作负极、Cu作正极,电池反应式为Fe+2Fe3+=3Fe2+,不能验证Fe3+与Cu2+氧化性强弱,错误;
②中铜作负极、银作正极,电池反应式为Cu+2Fe3+=Cu2++2Fe2+,能验证Fe3+与Cu2+氧化性强弱,正确;
③中铁发生钝化现象,Cu作负极、铁作正极,电池反应式为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,不能验证Fe3+与Cu2+氧化性强弱,错误;
④中铁作负极、铜作正极,电池反应式为:Fe+Cu2+=Cu+Fe2+,不能验证Fe3+与Cu2+氧化性强弱,错误;
答案选②;
(2)根据电子流向知,A为负极、B为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以A处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-=CO32-+7H2O;
(3)消耗硝酸银是0.02mol,根据Ag++Cl-=AgCl↓可知氯离子的物质的量是0.02mol,因此根据氯原子守恒可知氯化物的物质的量是0.01mol,相对分子质量是1.11÷0.01=111,则X的质量数是111-71=40,因此Z=40-20=20;
(4)2min后,测知c(H2)=0.5mo/L,因此分解的溴化氢是0.5mol/L×2=1.0mol/L,又因为平衡时c(HBr)=4mol/L,则溴化铵分解产生的溴化氢是1mol/L+4mol/L=5mol/L,根据方程式可知生成的氨气是5mol/L,则v(NH3)=5mol/L÷2min=2.5mol/(L·min)。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】某工厂将制革工业污泥中的铬元素以难溶物CrOH(H2O)5SO4的形式回收,工艺流程如下,其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。

回答下列问题:
(1)4.8 mol/L的硫酸溶液密度为1.27g/cm3,该溶液中硫酸的质量分数是_______。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:______。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
①Cr (OH)3溶解于NaOH溶液时反应的离子方程式是___________。
②加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有______;但溶液的pH不能超过8,其理由是______________________________。
(4)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____________。
(5)写出上述流程中用SO2进行还原时发生反应的化学方程式:_______________。





