��Ŀ����
����Ŀ��ij�������Ƹ﹤ҵ�����еĸ�Ԫ����������CrOH(H2O)5SO4����ʽ���գ������������£����������ȡҺ�еĽ���������Ҫ��Cr3+�������Fe3+��Al3+��Ca2+��Mg2+��
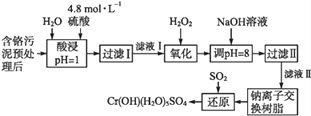
�ش��������⣺
��1��4.8 mol/L��������Һ�ܶ�Ϊ1.27g/cm3������Һ�����������������_______��
��2��H2O2�������ǽ���Һ���е�Cr3+ת��ΪCr2O72����д���˷�Ӧ�����ӷ���ʽ��______��
��3�������£�����������������������ʽ����ʱ��Һ��pH���£�
������ | Fe3+ | Mg2+ | Al3+ | Cr3+ |
��ʼ����ʱ��pH | 2.7 | �� | �� | �� |
������ȫʱ��pH | 3.7 | 11.1 | 5.4��>8�ܽ⣩ | 9��>9�ܽ⣩ |
��Cr (OH)3�ܽ���NaOH��Һʱ��Ӧ�����ӷ���ʽ��___________��
�ڼ���NaOH��Һʹ��Һ�ʼ��ԣ�Cr2O72��ת��ΪCrO42������Һ������������Ҫ��______������Һ��pH���ܳ���8����������______________________________��
��4�������ӽ�����֬�ķ�Ӧԭ��ΪMn++nNaR��MRn+nNa+�����������ӽ�����֬��ȥ��Һ���еĽ�����������_____________��
��5��д��������������SO2���л�ԭʱ������Ӧ�Ļ�ѧ����ʽ��_______________��
���𰸡� 37% 2Cr3+ + 3H2O2 + H2O![]() Cr2O72��+ 8H+ Cr (OH)3 + OH-
Cr2O72��+ 8H+ Cr (OH)3 + OH-![]() CrO2��+ 2H2O Na+��Ca2+��Mg2+ pH����8��ʹ����Al(OH)3�ܽ�����AlO2�� Ca2+��Mg2+ 3SO2 + 2Na2CrO4 +12H2O
CrO2��+ 2H2O Na+��Ca2+��Mg2+ pH����8��ʹ����Al(OH)3�ܽ�����AlO2�� Ca2+��Mg2+ 3SO2 + 2Na2CrO4 +12H2O![]() 2CrOH(H2O)5SO4�� + Na2SO4 + 2NaOH
2CrOH(H2O)5SO4�� + Na2SO4 + 2NaOH
����������������������̿�֪���������ྭ�������ˣ�����Һ�м���˫��ˮ��Cr3+����ΪCr2O72����Ȼ���������������Һ����pH��8��Cr2O72��ת��ΪCrO42��,Fe3+��Al3+��ȫ���������ˣ���Һ�������ӽ�����֬�������ӽ�������ȥCa2+��Mg2+���������Һ��ͨ�������Ķ�������CrO42����ԭΪCrOH(H2O)5SO4��
��1��4.8 mol/L��������Һ�ܶ�Ϊ1.27g/cm3������Һ�����������������![]() 37%��
37%��
��2�� H2O2�������ǽ���Һ���е�Cr3+ת��ΪCr2O72�����˷�Ӧ�����ӷ���ʽ��2Cr3+ + 3H2O2 + H2O![]() Cr2O72��+ 8H+��
Cr2O72��+ 8H+��
��3�������Al(OH)3����NaOH��Һ�ķ�Ӧ��Cr (OH)3�ܽ���NaOH��Һʱ��Ӧ�����ӷ���ʽ��Cr (OH)3 + OH-![]() CrO2��+ 2H2O��
CrO2��+ 2H2O��
�ڼ���NaOH��Һʹ��Һ�ʼ��ԣ�Cr2O72��ת��ΪCrO42������Һ������������Ҫ��Na+��Ca2+��Mg2+������Һ��pH���ܳ���8����������pH����8��ʹ����Al(OH)3�ܽ�����AlO2����
��4�������ӽ�����֬�ķ�Ӧԭ��ΪMn++nNaR��MRn+nNa+�����������ӽ�����֬��ȥ��Һ���еĽ�����������Ca2+��Mg2+��
��5��������������SO2���л�ԭʱ������Ӧ�Ļ�ѧ����ʽΪ3SO2 + 2Na2CrO4 +12H2O![]() 2CrOH(H2O)5SO4�� + Na2SO4 + 2NaOH��
2CrOH(H2O)5SO4�� + Na2SO4 + 2NaOH��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�