题目内容
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s) = 6AlCl(g)+6CO(g) ΔH=a kJ·mol-1
②3AlCl(g) = 2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH = kJ·mol-1 (用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) ΔH =Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH =Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10 min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.单位时间内生成2 n mol NO(g)的同时消耗n mol CO2(g)
B.反应体系的温度不再发生改变
C.混合气体的密度不再发生改变
D 反应体系的压强不再发生改变
(1)0.5a+b;(2)① 0.032mol/( L·min) ; 0.25;②A D;③B C
【解析】
试题分析:(1)①÷2+②。整理得Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH =(0.5a+b)kJ/mol (2) ①0~10 min内,NO的平均反应速率v(NO)=ΔC/Δt=(1.00-0.68)mol/L÷10min=0.032mol/( L·min).T1℃时,当反应达到平衡时,化学平衡常数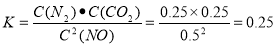 .②30 min后改变了一个条件,使化学平衡发生移动,当达到新的平衡后,各种物质的浓度都增大,由于
.②30 min后改变了一个条件,使化学平衡发生移动,当达到新的平衡后,各种物质的浓度都增大,由于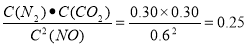 ,所以温度不变。A.通入一定量的NO 。会使反应物的浓度增大,化学平衡正向移动,由于该反应是反应前后气体体积相等的反应,所以反应物的转化率不变。最终达到平衡时各物质浓度增加的浓度比例相等。正确。B.加入一定量的活性炭,活性炭是固体,改变用量对平衡无影响。错误。C.加入合适的催化剂,只能加快反应速率,缩短达到平衡所需要的水解,化学平衡不发生移动。错误。D.适当缩小容器的体积。因为该反应是反应前后气体体积相等的反应,所以缩小容器的容积,平衡不会发生移动,单位体积内各种物质的浓度都增大。即反应物、生成物的浓度都增大。增大的比例不变。正确。③在恒容条件下,A.无论反应是否达到平衡,在任何时刻都存在单位时间内生成2 n mol NO(g)的同时消耗n mol CO2(g),所以不能作为判断反应是否达到平衡的标志。错误。B.该反应体系伴随着热效应,如果反应未达到平衡,则体系的温度必然发生变化,若不再发生改变,则必然已经达到平衡状态。正确。C,如果反应未达到平衡状态,就会有固体C的消耗或生成,气体的密度就会增大或减小。因此气体的密度不变,则反应达到了平衡状态。正确。D 由于该反应是个反应前后气体体积相等的反应,所以在容积固定的密闭容器中,在任何时刻都存在着反应体系的压强不变。因此反应体系的压强不变不能作为判断平衡是否达到的标志。错误。
,所以温度不变。A.通入一定量的NO 。会使反应物的浓度增大,化学平衡正向移动,由于该反应是反应前后气体体积相等的反应,所以反应物的转化率不变。最终达到平衡时各物质浓度增加的浓度比例相等。正确。B.加入一定量的活性炭,活性炭是固体,改变用量对平衡无影响。错误。C.加入合适的催化剂,只能加快反应速率,缩短达到平衡所需要的水解,化学平衡不发生移动。错误。D.适当缩小容器的体积。因为该反应是反应前后气体体积相等的反应,所以缩小容器的容积,平衡不会发生移动,单位体积内各种物质的浓度都增大。即反应物、生成物的浓度都增大。增大的比例不变。正确。③在恒容条件下,A.无论反应是否达到平衡,在任何时刻都存在单位时间内生成2 n mol NO(g)的同时消耗n mol CO2(g),所以不能作为判断反应是否达到平衡的标志。错误。B.该反应体系伴随着热效应,如果反应未达到平衡,则体系的温度必然发生变化,若不再发生改变,则必然已经达到平衡状态。正确。C,如果反应未达到平衡状态,就会有固体C的消耗或生成,气体的密度就会增大或减小。因此气体的密度不变,则反应达到了平衡状态。正确。D 由于该反应是个反应前后气体体积相等的反应,所以在容积固定的密闭容器中,在任何时刻都存在着反应体系的压强不变。因此反应体系的压强不变不能作为判断平衡是否达到的标志。错误。
考点:考查反应热、化学反应速率、化学平衡常数的计算及平衡状态的判断和影响因素的知识。