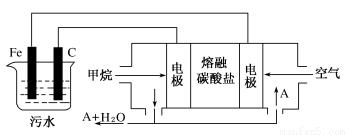
题目内容
下列溶液中有关物质的量浓度关系正确的是
A.25 ℃时pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH) < c(CH3COONa) < c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(OH-) = c(H+) + c(CH3COOH)
D.0.1 mol·L-1 的NaHA溶液,其pH=4: c(HA-) > c(H+) > c(H2A) > c(A2-)
A
【解析】
试题分析:A.在pH=2的HA溶液与pH=12的MOH的混合溶液中存在的离子有A-、B+、H+、OH-。根据电荷守恒可得c(H+) + c(M+) = c(OH-) + c(A-)。正确。B.NaOH是碱,电离使溶液显碱性,pH相等的CH3COONa和Na2CO3是盐,水解使溶液显碱性。盐的水解程度是很微弱的,所以当溶液的PH相同时物质的浓度C(盐)>C(碱)。酸性:CH3COOH>H2CO3根据盐的水解规律:谁弱谁水解,越弱越水解。所以PH相同时两种盐的浓度大小关系是c(CH3COONa) > c(Na2CO3)。因此pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(CH3COONa) > c(Na2CO3) > c(NaOH)。错误。C.根据电荷守恒可得c(CH3COO-) + c(OH-) = c(H+) + c(Na+)。根据物料守恒可得c(CH3COO-) + c(CH3COOH)= 2c(Na+) 。两式联立解得c(CH3COO-) +2c(OH-) = 2c(H+) + c(CH3COOH).错误。D.0.1 mol·L-1 的NaHA溶液,其pH=4,说明HA-的电离作用大于它的水解作用,所以c(A2-) >c(H2A)。由于盐的电离和水解的程度都是很微弱的,所以c(HA-) >c(A2-)>c(H2A)。在溶液中除了存在HA-的电离外,还存在着水的电离平衡。所以c(H+) >c(A2-) 。因此在该溶液中各微粒的浓度关系为: c(HA-) > c(H+) >c(A2-) >c(H2A) 。错误。
考点:考查溶液中离子浓度的大小比较的知识。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s) = 6AlCl(g)+6CO(g) ΔH=a kJ·mol-1
②3AlCl(g) = 2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH = kJ·mol-1 (用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) ΔH =Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH =Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10 min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.单位时间内生成2 n mol NO(g)的同时消耗n mol CO2(g)
B.反应体系的温度不再发生改变
C.混合气体的密度不再发生改变
D 反应体系的压强不再发生改变
四个体积相同的密闭容器中在一定的条件下发生反应: 2SO2+O2 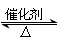 2SO3,反应开始时,反应速率由大到小排列顺序正确的是
2SO3,反应开始时,反应速率由大到小排列顺序正确的是
容器 | 温度 | SO2(mol) | O2(mol) | 催化剂 |
甲 | 500℃ | 10 | 5 | - |
乙 | 500℃ | 10 | 5 | V2O5 |
丙 | 450℃ | 8 | 5 | - |
丁 | 500℃ | 8 | 5 | - |
A.乙>甲>丁>丙 B.乙>甲>丙>丁 C.甲>乙=丁>丙 D.乙>甲>丙=丁