题目内容
【题目】 氮和碳的化合物与人类生产、生活密切相关。
(1)已知:N2(g)+O2(g)===2NO(g); ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g); ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH= 。
(2)在压强为0.1 MPa条件,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为
CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①下列能说明该反应达到平衡状态的是 。
a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化
c.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变
②T1℃时,在一个体积为5 L的恒压容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。
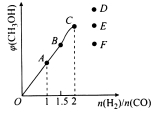
③在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当![]() 时,达到平衡状态,CH3OH的体积分数可能是图象中的 点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的 点。
(3)用催化转化装置净化汽车尾气,装置中涉及的反应之一为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
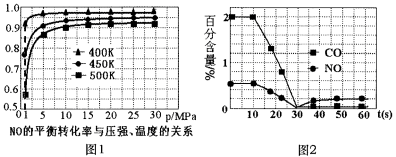
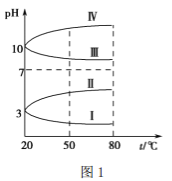
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。催化装置比较适合的温度和压强是___________。
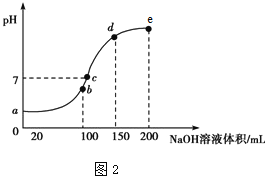
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图2所示。则前10 s内,CO和NO百分含量没明显变化的原因是____________。
(4)右图所示的装置能吸收和转化NO2和SO2。
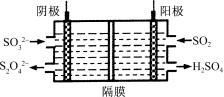
①阳极区的电极反应式为 。
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO![]() 可在阴极区再生。写出该反应的离子方程式: 。
可在阴极区再生。写出该反应的离子方程式: 。
【答案】(1)-664.1 kJ·mol-1
(2)①ad ②75 ③F
(3)①400K,1MPa②尚未达到催化剂工作温度或尚未达到反应所需的温度
(4)① SO2-2e-+2H2O===SO![]() +4H+
+4H+
② 4S2O![]() +2 NO2+8OH-=8SO
+2 NO2+8OH-=8SO![]() +N2+4H2O
+N2+4H2O
【解析】
(1)②-①得:ΔH=—483.6—180.5=-664.1 kJ·mol-1。
(2) ①恒压条件下,CO(g)+2H2(g) ![]() CH3OH(g)是一个体积变化的可逆反应,所以混合气体的密度不再变化、CO在混合气中的质量分数保持不变是平衡状态,选ad。
CH3OH(g)是一个体积变化的可逆反应,所以混合气体的密度不再变化、CO在混合气中的质量分数保持不变是平衡状态,选ad。
② 三段式: CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
开始 1mol 2mol 0
变化 0.75mol 1.5mol 0.75mol
平衡 0.25mol 0.5mol 0.75mol
平衡时共有0.25mol+ 0.5mol+ 0.75mol=1.5 mol
平衡时的体积为1.5×5/3=2.5L
各物质浓度为c(CO)=0.1mol/L ,c(H2)=0.2mol/L ,c(CH3OH)=0.3 mol/L,平衡常数K=0.3/(0.1×0.22)=75
③温度不变,当![]() 时,相当于多加了H2,CH3OH的体积分数比等于2时要小,可能是图中的F点。
时,相当于多加了H2,CH3OH的体积分数比等于2时要小,可能是图中的F点。
(3) ①从图中可以看出,400K,1MPaNO平衡转化率已较大。
②前10 s内,CO和NO百分含量没明显变化,说明尚未达到催化剂工作温度或尚未达到反应所需的温度。
(4) ①阳极区是SO2的氧化,电极反应式为SO2-2e-+2H2O===SO![]() +4H+
+4H+
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,应是N2,同时生成的SO
离子,能将NO2气体转化为无污染气体,应是N2,同时生成的SO![]() ,离子方程式为:4S2O
,离子方程式为:4S2O![]() +2 NO2+8OH-=8SO
+2 NO2+8OH-=8SO![]() +N2+4H2O。
+N2+4H2O。

 阅读快车系列答案
阅读快车系列答案【题目】N2O5在一定温度下可发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol/ L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3