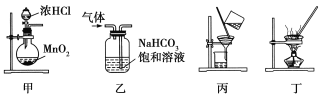
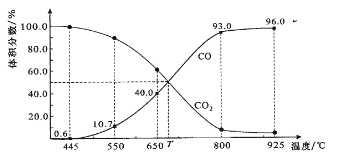
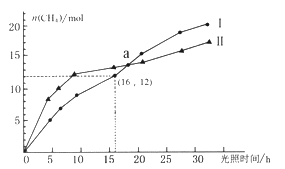
题目内容
【题目】下列物质中,含有非极性共价键的是( )
A.N2
B.CO2
C.NaOH
D.CH4
【答案】A
【解析】解:A.N2中N原子之间形成非极性共价键,故A正确;
B.CO2中中不同非金属元素之间形成极性键,故B错误;
C.氢氧化钠中钠离子和氢氧根离子之间存在离子键、氢原子和氧原子之间存在极性共价键,故C错误;
D.CH4中C原子和H原子之间存在极性共价键,故D错误;
故选A.
【考点精析】本题主要考查了极性键和非极性键的相关知识点,需要掌握非极性键:由同种元素的原子间的原子间形成的共价键(共用电子对不偏移);极性键:由不同元素的原子间形成的共价键(共用电子对偏向吸引电子能力强的一方)才能正确解答此题.

【题目】已知硫铁矿的主要成分是FeS2(铁元素呈+2价,硫元素呈—1价)。以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
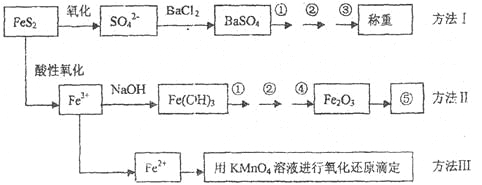
请同答下列问题:
(1)流程图中操作①、②、③分别指的是:①____________、②___________、③________。
操作④、⑤用到的主要仪器是:④_________、⑤__________(每空填1~2个仪器)。
(2)判断溶液中SO42-离子己沉淀完全的方法是______________________________________。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,需要准确配制KMnO4标准溶液,下列因素导致所配制的溶液浓度偏大的有
A.砝码生锈 | B.定容时俯视 |
C.称量时物质和砝码位置反了(需要游码) | D.容量瓶用待装液润 |
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是______________________________________。
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是_________________________。