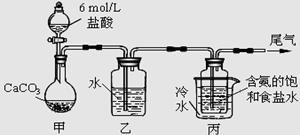
题目内容
在实验室里,某同学取一小块金属钠做钠与水反应的实验。试完成下列问题:
(1)切开的金属钠暴露在空气中,最先观察到的现象是____________________________,所发生反应的化学方程式是_______________________________________________。
(2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是
①_______________________________________________,
②_______________________________________________。
将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是________。
(3)钠与硫酸铜溶液反应的离子方程式为____________________________________。在反应过程中,若生成标准状况下224 mL的H2,则转移的电子的物质的量为________。
(1)切开的金属钠暴露在空气中,最先观察到的现象是____________________________,所发生反应的化学方程式是_______________________________________________。
(2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是
①_______________________________________________,
②_______________________________________________。
将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是________。
| A.有气体生成 |
| B.钠熔化成小球并在液面上游动 |
| C.烧杯底部有银白色的金属钙生成 |
| D.溶液变浑浊 |
(1)钠块表面由银白色变为暗灰色 4Na+O2=2Na2O
(2)钠与水反应放出热量 钠的熔点低 C (各1分)
(3) 2Na+2H2O+Cu2+=Cu(OH)2↓+H2↑+2Na+ 0.02 mol (各2分)
(2)钠与水反应放出热量 钠的熔点低 C (各1分)
(3) 2Na+2H2O+Cu2+=Cu(OH)2↓+H2↑+2Na+ 0.02 mol (各2分)
试题分析:(1)钠是活泼的金属,极易被氧化。所以切开的金属钠暴露在空气中,最先观察到的现象是钠块表面由银白色变为暗灰色,反应的化学方程式为4Na+O2=2Na2O。
(2)钠投入水中后,钠熔化成一个小球,这说明该反应是放热反应,且钠的熔点低。钠的密度小于水的,极易与水反应生成氢氧化钠和氢气,所以将一小块钠投入盛有饱和石灰水的烧杯中可以观察到有气体生成、钠熔化成小球并在液面上游动。由于反应放热,且氢氧化钙的溶解度随温度的升高而降低,因此有氢氧化钙固体析出,所以溶液变浑浊。但在溶液中钠不可能置换出钙,C不正确,答案选C。
(3)啊极易与水反应生成氢氧化钠和氢气,因此钠投入到盐溶液中,首先与水反应,然后生成的氢氧化钠再与盐溶液中的溶质发生复分解反应,因此钠投入到硫酸铜溶液中反应的离子方程式为2Na+2H2O+Cu2+=Cu(OH)2↓+H2↑+2Na+。标准状况下224 mL H2的物质的量=0.224L÷22.4L/mol=0.01mol,其中氢元素的化合价从+1价降低到0价,得到1个电子,因此生成1mol氢气转移2mol电子,所以反应中转移电子的物质的量=0.01mol×2=0.02mol。

练习册系列答案
相关题目
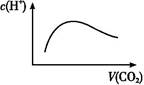
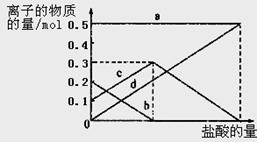
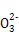 )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)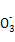 )>c(H+)
)>c(H+)

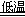 NaHCO3↓+NH4Cl,处理母液的两种方法:
NaHCO3↓+NH4Cl,处理母液的两种方法: