题目内容
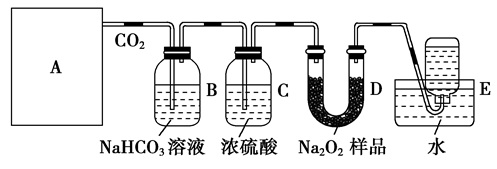
工业生产纯碱的工艺流程示意图如下:

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A 、B 。
(2)碳酸化后发生反应的化学方程式是 。
(3)向母液 (选填图中字母)中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(4)不用其它试剂,检查副产品NH4Cl是否纯净的方法及操作是 .
(5)Xg纯碱产品(含有碳酸氢钠)充分加热分解后,质量减少了Yg,则纯碱样品中碳酸氢钠的质量分数可表示为 。
(6)有人以硫酸钠和焦炭、石灰石在高温下进行煅烧,再浸取,结晶而制得纯碱。反应的化学方程式为_________ __ (已知产物之一为CaS);

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A 、B 。
(2)碳酸化后发生反应的化学方程式是 。
(3)向母液 (选填图中字母)中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(4)不用其它试剂,检查副产品NH4Cl是否纯净的方法及操作是 .
(5)Xg纯碱产品(含有碳酸氢钠)充分加热分解后,质量减少了Yg,则纯碱样品中碳酸氢钠的质量分数可表示为 。
(6)有人以硫酸钠和焦炭、石灰石在高温下进行煅烧,再浸取,结晶而制得纯碱。反应的化学方程式为_________ __ (已知产物之一为CaS);
(1) Ca(OH)2或CaO;Na2CO3
(2)NH3+CO2+H2O+NaCl→NH4Cl+NaHCO3↓
(3)D,AC
(4)加热法;取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净
(5)ω(NaHCO3)="84Y/" 31X
(6)Na2SO4+ 2C+CaCO3 CaS+Na2CO3+2CO2↑
CaS+Na2CO3+2CO2↑
(2)NH3+CO2+H2O+NaCl→NH4Cl+NaHCO3↓
(3)D,AC
(4)加热法;取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净
(5)ω(NaHCO3)="84Y/" 31X
(6)Na2SO4+ 2C+CaCO3
 CaS+Na2CO3+2CO2↑
CaS+Na2CO3+2CO2↑试题分析:(1)粗盐水中含有Mg2+、Ca2+、用Ca(OH)2或CaO将Mg2+转化为Mg(OH)2 ,再用Na2CO3将Ca2+转化为CaCO3沉淀,答案:Ca(OH)2或CaO Na2CO3 。
(2)由于溶液中存在氨气,氯化钠,当通入二氧化碳后,碳酸化后发生反应的化学方程式是NH3+CO2+H2O+NaCl→NH4Cl+NaHCO3↓。
(3)根据操作过程,氨化后通入二氧化碳的溶液发生复分解反应:H2O+CO2+NH3+NaCl=NaHCO3+NH4Cl,最终得到NH4Cl还有NaHCO3等,碳酸氢钠溶解度很小而结晶,故酸化后滤液的主要成分为:NH4Cl,故向母液D中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有增大NH4+的浓度,使NH4Cl更多地析出,同时使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度。
(4)由于NH4Cl受热易分解可采用加热方法验证其是否纯净,具体方法是:取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净。
(5)根据碳酸氢钠受热分解生成碳酸钠和二氧化碳和水,由题信息可知加热前纯碱的质量为 Xg,加热后损失的质量为:Yg,则纯碱中碳酸氢钠的质量分数为:84Y/31X;
(6)根据题题目的信息确定出反应物和生成物,故反应方程式为Na2SO4+ 2C+CaCO3
 CaS+Na2CO3+2CO2↑。
CaS+Na2CO3+2CO2↑。
练习册系列答案
相关题目