题目内容
【题目】磷及其化合物在化工生产中有着广泛的应用,请对下列问题作答。
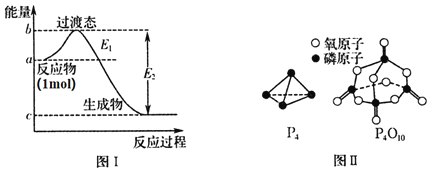
![]() 有多种单质,其中一种叫白磷,分子式为
有多种单质,其中一种叫白磷,分子式为![]() ,结构如图Ⅱ所示,
,结构如图Ⅱ所示,![]() 分子的活泼性比
分子的活泼性比![]() 分子______
分子______![]() 填强或弱
填强或弱![]() 。
。
![]() 白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设
白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设![]() 、
、![]() 、
、![]() 的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出
的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出![]() 的键能的表达式为______
的键能的表达式为______
![]() 已知含氧酸分子中只有羟基中的氢原子才能发生电离。
已知含氧酸分子中只有羟基中的氢原子才能发生电离。![]() 具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
![]() 可用于化学镀镍。配平并完成下列化学方程式:
可用于化学镀镍。配平并完成下列化学方程式:
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______
![]() 磷酸是一种三元中强酸,已知
磷酸是一种三元中强酸,已知![]() ,
,![]() ,
,![]() ,
,![]() 的水溶液显______性,解释原因______。
的水溶液显______性,解释原因______。
![]() 是重要的化工原料,某温度下,反应
是重要的化工原料,某温度下,反应![]() 的化学平衡常数
的化学平衡常数![]() ,在1L的密闭容器中加入
,在1L的密闭容器中加入![]() ,平衡后
,平衡后![]() 的浓度是______。
的浓度是______。
【答案】强 ![]()
![]() ;
; ![]() 1
1 ![]() 1 1
1 1 ![]() 酸
酸 ![]() 离子的水解常数为
离子的水解常数为![]() ,小于其电离常数
,小于其电离常数![]() ,所以显酸性
,所以显酸性 ![]()
【解析】
(1)P4分子中为单键结构,N2为三键结构,能量越高越活泼;
(2)白磷燃烧的方程式为P4+502=P4O10,根据化学键的断裂和形成的数目和焓变=反应物总键能-生成物总键能进行计算;
(3)已知含氧酸分子中只有羟基中的氢原子才能发生电离。H3PO2具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,为一元弱酸;
(4)根据氧化还原反应中化合价变化及质量守恒定律判断反应物和生成物,并配平反应方程式;
(5)NaH2PO4的水溶液中存在水解平衡,H2PO4+H2OH3PO4+OH,Kh=c(H3PO4)c(OH)c(H2PO4)=Kw÷Ka1,比较水解平衡常数和电离平衡常数判断电离程度和水解程度大小来确定溶液酸碱性;
(6)结合好三行计算列式计算平衡浓度,利用平衡常数表达式列式计算得到,逆反应平衡常数和正反应平衡常数互为倒数;
![]() 分子中为单键结构,磷原子半径大于氮原子,
分子中为单键结构,磷原子半径大于氮原子,![]() 为三键结构,所以
为三键结构,所以![]() 分子的活泼性强,故答案为:强;
分子的活泼性强,故答案为:强;
![]() 白磷燃烧的方程式为
白磷燃烧的方程式为![]() ,1mol白磷完全燃烧需拆开
,1mol白磷完全燃烧需拆开![]() 、
、![]() ,形成
,形成![]() 、
、![]() ,设
,设![]() 的键能为m,则根据反应热等于反应物的键能总和与生成物的键能总和的差可知,
的键能为m,则根据反应热等于反应物的键能总和与生成物的键能总和的差可知,![]() ,
,![]() ,故答案为:
,故答案为:![]() ;
;
![]() 已知含氧酸分子中只有羟基中的氢原子才能发生电离。
已知含氧酸分子中只有羟基中的氢原子才能发生电离。![]() 具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,为一元弱酸,电离方程式为:
具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,为一元弱酸,电离方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 由氧化还原反应中化合价升降相等进行配平:镍元素的化合价降低了2价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:
由氧化还原反应中化合价升降相等进行配平:镍元素的化合价降低了2价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:![]() ,故答案为:1、1、
,故答案为:1、1、![]() 、1、1、
、1、1、![]() ;
;
![]() 的水溶液中存在水解平衡,
的水溶液中存在水解平衡,![]() ,
, ,溶液中电离程度大,溶液显酸性,故答案为:酸;
,溶液中电离程度大,溶液显酸性,故答案为:酸;![]() 离子的水解常数为
离子的水解常数为![]() ,小于其电离常数
,小于其电离常数![]() ,所以显酸性;
,所以显酸性;
![]() 利用三行计算列式,某温度下,反应
利用三行计算列式,某温度下,反应![]() 的化学平衡常数
的化学平衡常数![]() ,则逆反应平衡常数
,则逆反应平衡常数![]() ,设生成氯气物质的量浓度为x:
,设生成氯气物质的量浓度为x:
![]()
起始量![]() 0 0
0 0
变化量![]() x x x
x x x
平衡量![]() x x
x x
![]() ,
,![]() ,故答案为:
,故答案为:![]() 。
。

【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列问题:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置______,基态E2+价电子的排布图为_______,B元素能量最高的电子其轨道呈_______形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为___________。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为_____________,B、C、D简单离子的半径由大到小的顺序为_________。
(4)写出C的核外有18个电子的氢化物的电子式________。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO = E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___________。
(6)已知沸点:B2H4>A2H6 ,主要原因为____________________。
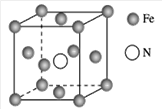
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。
【题目】下表为25℃的三种弱酸的电离平衡常数:
化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因_________________________。
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为_______________。
(3)写出NaA溶液中通少量CO2的离子方程式____________________。
(4)现有Na2CO3和NaHCO3两种白色固体物质,欲探究Na2CO3和NaHCO3稳定性的相对强弱,设计了以下实验:

①如上图所示,试管④中装入的固体应该是_________(填化学式)。
②通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性更_______(填“强”或“弱”)。