题目内容
【题目】一定温度时,向2.0L恒容密闭容器中充入2molSO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前2s的平均速率v(O2)=0.2mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4molSO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变向该容器中再充入2molSO2、1molO2,反应达到新平衡时![]() 增大
增大
【答案】D
【解析】
A.反应反应在前2s的平均速率v(SO3) ,同一反应中速率之比等于计量数之比,所以v(O2)=
,同一反应中速率之比等于计量数之比,所以v(O2)=![]() ×0.2mol·L-1·s-1=0.1mol·L-1·s-1,故A错误;
×0.2mol·L-1·s-1=0.1mol·L-1·s-1,故A错误;
B.平衡常数只受温度的影响,保持其他条件不变,体积压缩到1.0L,平衡常数不变,故B错误;
C. 充入2molSO2和1mol O2,相当于充入2molSO3,此时SO3的转化率为![]() ,相同温度下,起始时向容器中充入4molSO3,假设达到的是等效平衡,则转化率不变,实际上相当于增大压强,平衡会右移,降低三氧化硫的转化率,故C错误;
,相同温度下,起始时向容器中充入4molSO3,假设达到的是等效平衡,则转化率不变,实际上相当于增大压强,平衡会右移,降低三氧化硫的转化率,故C错误;
D. 温度不变,向该容器中再充入2mol SO2、1mol O2,若保持与原平衡的压强相同,则可达到等效平衡,![]() 不变;然后将容器压缩到原容器的体积,则平衡正向移动,二氧化硫的转化率增大,氧气的的转化率也增大,所以该比值增大,故D正确。
不变;然后将容器压缩到原容器的体积,则平衡正向移动,二氧化硫的转化率增大,氧气的的转化率也增大,所以该比值增大,故D正确。
故答案为D。

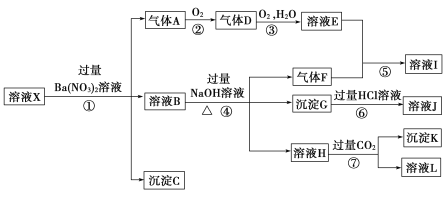
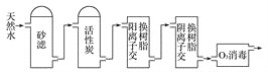
【题目】碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是______________(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为____________。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的化学方程式为_____________。
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,,关闭活塞a。

① B中反应的离子方程式是________。
②通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.挥发性 B. 还原性 C. 氧化性 D. 酸性
③ C装置中的试剂X是________(写化学式)。D中反应的化学方程式是________。
④碳、硅的非金属性逐渐减弱的原因:碳和硅______。
【题目】一定温度下,在3个容积均为1.0L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。下列说法正确的是
PCl3(g)+Cl2(g)。下列说法正确的是
容器 编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(PCl5) | c(PCl3) | c(Cl2) | c(Cl2) | |
Ⅰ | 0.4 | 0 | 0 | 0.2 |
Ⅱ | 1.05 | 0.05 | 1.95 | |
Ⅲ | 0.8 | 0 | 0 | |
A.达平衡时,容器Ⅰ中![]() 比容器Ⅱ中的大
比容器Ⅱ中的大
B.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为6∶31
C.达平衡时,容器Ⅲ中Cl2的体积分数大于![]()
D.达平衡时,容器Ⅲ中0.4mol·L-1<c(PCl5)<0.8mol·L-1